题目内容
15.下列反应的离子方程式正确的是( )| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ |
分析 A.氨水中的一水合氨是弱电解质要写成分子式的形式;
B.碳酸钙为难溶物,离子方程式中不能拆开;
C.铜与铁离子能够发生氧化还原反应生成亚铁离子和铜离子;
D.碳酸氢根离子不能拆开,应该保留整体形式.
解答 解:A.氨水中的一水合氨是弱电解质要写成分子式的形式,所以向AlCl3溶液中加入过量的氨水,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.碳酸钙属于难溶物,需要保留化学式,正确的离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,故B错误;
C.铜片加入三氯化铁溶液中,铁离子与铜发生氧化还原反应,反应的离子方程式为:Cu+2Fe3+═2Fe2++Cu2+,故C正确;
D.碳酸氢根离子需要保留整体形式,正确的离子方程式为:HCO3-+H+═H2O+CO2↑,故D错误;
故选C.
点评 本题考查离子反应方程式的正误判断,题目难度中等,明确发生的化学反应及离子反应的书写方法即可解答,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
5.下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| B | Fe | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| C | Mg | 0.1 | 3mol•L-1硫酸 | 10mL | 25℃ |
| D | Mg | 0.1 | 6mol•L-1硝酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
6.(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
将2mol该混合气体通入足量的溴的四氯化碳溶液中,消耗Br2的物质的量为1mol.
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为 .
.
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为
 .
.
20.在一不能压缩的容器中,A(g)+3B(g)?2C(g)△H<0,下列说法正确的是( )
| A. | 温度升高,压强增大,平衡可能不移动 | |
| B. | 改变条件,A的转化率降低,平衡一定向正反应方向移动 | |
| C. | 只增大C的浓度,相当于加压,平衡向正反应方向移动 | |
| D. | 加入A,再次达平衡,C的体积分数可能降低 |
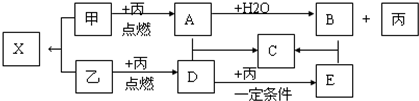
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料. 酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图:
酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图: