题目内容
4. CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.(1)已知CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)能量变化如图,下列说法正确的是CD
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1mol H-O键断裂的同时2mol C=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,4min内平均反应速度v(H2)=0.8mol•L-1•min-1,则CH3OH的转化率为64%.
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.则下列说法正确的是CD.
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-═CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
①若电解质溶液改为酸溶液,请写出甲醇燃料电池的负极电极反应式CH3OH-6e-+H2O═CO2↑+6H+.
②与铅蓄电池相比,当消耗相同质量的负极活性物质时,甲醇燃料电池的理论放电量是铅蓄电池的19.4倍(保留一位小数).
③肼(N2H4)-空气燃料电池也是一种很有发展前景、对环境很友好的碱性电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=4H2O+N2↑.
分析 (1)A、反应物的能量高于生成物的能量,反应是放热的,反之是吸热的;
B、化学反应速率之比等于系数之比;
C、化学变化伴随物质变化,同时也一定有能量变化;
D、当化学反应得到平衡状态时,反应达到了最大限度.
(2)根据化学反应速率v=$\frac{△c}{△t}$计算反应速率,根据三行式结合转化率等于变化量和初始量的比值计算转化率;
(3)根据电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O知,负极甲醇失去电子发生氧化反应;正极上氧气得电子发生还原反应,根据电池反应式判断溶液的pH值变化;
①甲醇燃料电池的负极上是甲醇失电子的氧化反应,据电解质环境书写电极反应式;
②根据负极上的反应,消耗负极质量减少一样多时,转移得电子的物质的量即可;
③肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气.
解答 解:(1)A、根据图示反应物的能量高于生成物的能量,反应是放热的,故A错误;
B、化学反应速率之比等于系数之比,H2的生成速率与CH3OH的消耗速率之比为2:1,故B错误;
C、化学变化伴随物质变化,同时也一定有能量变化,故C正确;
D、当化学反应得到平衡状态时,反应达到了最大限度,1mol H-O键断裂的同时2mol C=O键断裂,说明正逆反应速率相等,达到了平衡,故D正确.
故选CD.
(2)经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,氧气的变化浓度1.0mol/L-0.2mol/L=0.8mol/L.
CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)
初始浓度:2.5 1 0 0
变化浓度:1.6 0.8 1.6 3.2
末态浓度:0.9 0.2 1.6 3.2
4min内平均反应速度v(H2)=$\frac{3.2mol/L}{4min}$=0.8mol/(L•min),CH3OH的转化率$\frac{1.6}{2.5}$×100%=64%,故答案为:0.8mol•L-1•min-1;64%;
(3)A、正极氧气上得电子发生还原反应,则氧气参与反应的电极为正极,故A错误;
B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故B错误;
C、电池总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O,反应消耗氢氧根离子,所以反应后溶液的pH减小,碱性减弱,故C正确;
D、甲醇失电子和氢氧根离子反应生成碳酸根离子和水,则电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,所以电池放电时每消耗1 mol CH3OH转移6 mol电子,每消耗6.4gCH3OH转移1.2mol电子,故D正确;
故选CD;
①甲醇燃料电池的负极上是甲醇失电子的氧化反应,酸性电解质环境下电极反应式为:CH3OH-6e-+H2O═CO2↑+6H+,故答案为:CH3OH-6e-+H2O═CO2↑+6H+;
②根据负极上的电极反应式:CH3OH-6e-+H2O═CO2↑+6H+,消耗1g甲醇,转移电子的物质的量是$\frac{3}{16}$mol,铅蓄电池的负极上发生的反应为:Pb-2e-+SO42-=PbSO4,
消耗1gPb,转移电子的物质的量是$\frac{2}{207}$mol,所以当消耗相同质量的负极活性物质时,甲醇燃料电池的理论放电量是铅蓄电池的比值是:$\frac{3}{16}:\frac{2}{207}$=19.4,故答案为:19.4;
③肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,故答案为:N2H4-4e-+4OH-═N2↑+4H2O.
点评 本题考查了化学反应速率、平衡的有关计算、原电池原理等知识,明确正负极上得失电子及反应类型是解本题关键,难点是电极反应式的书写.

| A. | 氧化还原原理 | B. | 溶解沉淀原理 | C. | 平衡移动原理 | D. | 物质两性原理 |
| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ |
| A. | Na2O2-淡黄色固体,可用作漂白剂 | B. | Na2O-白色固体,溶于水生成NaOH | ||
| C. | NaOH-性质稳定,可治疗胃酸过多 | D. | NaHCO3-受热易分解,可用作发酵粉 |
| A. | v(D)=0.5mol•L-1•min-1 | B. | v(C)=0.40 mol•L-1•min-1 | ||
| C. | v(B)=0.45 mol•L-1•s-1 | D. | v(A)=0.3mol•L-1•s-1 |
| A. | KCl、NaOH | B. | CO2、HCl | C. | CaCl2、NH4NO3 | D. | Na2O2、H2O2 |
| A. | 乙醇、1-己烯、苯酚 | B. | 正己烷、1-己醇、溴乙烷 | ||
| C. | 乙烯、丙烯、乙烷 | D. | 乙醇、乙醛、乙酸 |
| A. | 一定条件下2molSO2和1molO2充分反应后,混合气体的分子总数大于2NA | |
| B. | 常温常压下,64gO2和O3混合气体中含有原子总数为4NA | |
| C. | 1molCl2与NaOH溶液反应,转移的电子总数为2NA | |
| D. | 标准状况下,22.4LN2含共用电子对数为3NA |
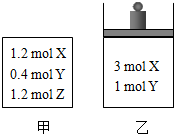 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )| 恒容容器甲 | 恒压容器乙 | |
| Y的物质的量/mol | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前大 | |
| B. | 平衡时容器甲的压强一定比反应前大 | |
| C. | n2>n1 | |
| D. | φ2>φ1 |