题目内容
20.在一不能压缩的容器中,A(g)+3B(g)?2C(g)△H<0,下列说法正确的是( )| A. | 温度升高,压强增大,平衡可能不移动 | |
| B. | 改变条件,A的转化率降低,平衡一定向正反应方向移动 | |
| C. | 只增大C的浓度,相当于加压,平衡向正反应方向移动 | |
| D. | 加入A,再次达平衡,C的体积分数可能降低 |
分析 A、温度升高,平衡向着吸热的方向移动;
B、减少B的量,平衡向逆反应方向移动,则可使A的转化率降低;
C、只增大C的浓度即增大生成物的浓度,平衡向逆反应方向移动;
D、加入A,平衡向正反应方向移动,C的物质的量增加,但由于增加A,总的物质的量可能增加的更大,据此分析.
解答 解:A、温度升高,平衡向着吸热的方向移动,所以平衡不可能不移动,故A错误;
B、减少B的量,平衡向逆反应方向移动,则可使A的转化率降低,所以平衡不一定向正反应方向移动,故B错误;
C、只增大C的浓度即增大生成物的浓度,平衡向逆反应方向移动,故C错误;
D、加入A即增大反应物的浓度,平衡向正反应方向移动,C的物质的量增加,但由于增加A,总的物质的量可能增加的更大,所以C的体积分数可能降低,故D正确.
故选D.
点评 本题考查学生化学平衡移动原理,难度不大,注意浓度、温度、压强等对平衡移动的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10ml0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
8.常温下,向20 mL 0.01 mol•L-1 HA溶液中逐滴加入 0.01 mol•L-1 MOH溶液过程中,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法中错误的是( )
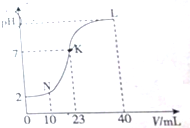

| A. | K点时的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N点时的溶液:2c(M+)=c(A-) | |
| C. | L点时的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水电离的程度:K>L>N |
15.下列反应的离子方程式正确的是( )
| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ |
5.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LSO3所含电子数约为40NA | |
| B. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| C. | 48gO2,O3混合气体含有的氧原子数为3NA | |
| D. | 1molCl2作为氧化剂得到的电子数一定为NA |
12.下列钠的化合物与其性质或用途不相符的是( )
| A. | Na2O2-淡黄色固体,可用作漂白剂 | B. | Na2O-白色固体,溶于水生成NaOH | ||
| C. | NaOH-性质稳定,可治疗胃酸过多 | D. | NaHCO3-受热易分解,可用作发酵粉 |
9.下列物质中所含有的化学键类型完全相同的一组是( )
| A. | KCl、NaOH | B. | CO2、HCl | C. | CaCl2、NH4NO3 | D. | Na2O2、H2O2 |
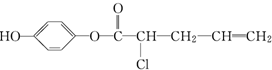 ,其不可能发生的反应有( )
,其不可能发生的反应有( )