题目内容
6.(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为
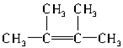 .
.
分析 (1)已知混合气体为2mol,其中乙烯为50%,则乙烯为1mol,根据反应方程式计算消耗的溴;
(2)根据原子守恒计算烃分子中N(C)、N(H),进而确定烃的分子式;根据乙烯的分子结构可知与C=C相连的原子在一个平面内,要保证6个碳原子在一个平面内,则另外4个碳必须直接与C=C相连.
解答 解:(1)已知混合气体为2mol,其中乙烯为50%,则乙烯为1mol,乙烯与溴反应的方程式为CH2=CH2+Br2→CH2Br-CH2Br,则消耗Br2的物质的量为1mol;
故答案为:1mol;
(2)完全燃烧0.2mol某烃,得到的两种生成物的物质的量均为1.2mol,则生成1.2molCO2和1.2molH2O,
故烃分子中N(C)=$\frac{1.2mol×1}{0.2mol}$=6,N(H)=$\frac{1.2mol×2}{0.2mol}$=12,
所以该烃的分子式是C6H12,
根据乙烯的分子结构可知与C=C相连的原子在一个平面内,要保证6个碳原子在一个平面内,则另外4个碳必须直接与C=C相连,结构简式为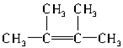 ,
,
故答案为:C6H12;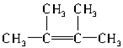 .
.
点评 本题考查有机物分子式的确定、同分异构体,题目比较基础,注意掌握燃烧法利用原子守恒确定分子式以及原子共面的判断方法.

练习册系列答案
相关题目
16.常温下,以下溶液中c(H+)最小的是( )
| A. | pH=0的某溶液 | B. | 0.1 mol•L-1 NaOH 溶液 | ||
| C. | 0.1mol•L-1 HCl 溶液 | D. | 0.1 mol•L-1的 NaCl 溶液 |
17.常温下,有下列5种溶液
回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH>③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①>④,
(2)在相同温度时,10mL ①的溶液与100mL ②的溶液相比较,下列数值后者大于前者的是BC(填字母).
A.中和时所需NaOH的量 B.电离程度 C.水电离出的c(H+) D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是AB(填字母).
A.C(OH-)B.$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体多(填“多”、“少”或“相等”).
| ① | ② | ③ | ④ | ⑤ |
| 0.1mol•L-1CH3COOH溶液 | 0.01mol•L-1CH3COOH溶液 | pH=3的CH3COOH溶液 | 0.1mol•L-1NaOH溶液 | 0.1mol•L-1氨水 |
(1)溶液①稀释到原来的100倍后的溶液pH>③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①>④,
(2)在相同温度时,10mL ①的溶液与100mL ②的溶液相比较,下列数值后者大于前者的是BC(填字母).
A.中和时所需NaOH的量 B.电离程度 C.水电离出的c(H+) D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是AB(填字母).
A.C(OH-)B.$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体多(填“多”、“少”或“相等”).
14.苯酚溶液滴入氯化铁溶液,发生Fe3+(黄色)+6C6H5OH?[Fe(C6H5O)6]3-(紫色)+6H+溶液呈紫色,再加入铁粉或少量氢氧化钠溶液或少量浓盐酸等,都会使紫色褪去.与这些现象无关的是( )
| A. | 氧化还原原理 | B. | 溶解沉淀原理 | C. | 平衡移动原理 | D. | 物质两性原理 |
1.下列关于铵盐叙述合理组合的是( )
(1)都是晶体
(2)都易溶于水
(3)加热都有氨气生成
(4)在溶液中和碱加热反应能放出氨气
(5)固体时和碱混合加热也能产生氨气.
(1)都是晶体
(2)都易溶于水
(3)加热都有氨气生成
(4)在溶液中和碱加热反应能放出氨气
(5)固体时和碱混合加热也能产生氨气.
| A. | (1)(2)(3)(5) | B. | (1)(2)(4)(5) | C. | (2)(4)(5) | D. | 都合理 |
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10ml0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
18.下列说法中正确的是( )
| A. | 具有足够能量的分子相互碰撞不一定能发生化学反应 | |
| B. | 强酸溶液的导电能力不一定比弱酸溶液大 | |
| C. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 溶度积大的化合物溶解度一定大 |
15.下列反应的离子方程式正确的是( )
| A. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ |
16.下列各组有机物用酸性重铬酸钾溶液即可鉴别的是( )
| A. | 乙醇、1-己烯、苯酚 | B. | 正己烷、1-己醇、溴乙烷 | ||
| C. | 乙烯、丙烯、乙烷 | D. | 乙醇、乙醛、乙酸 |