题目内容
9. 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域(1)基态氮原子的核外电子排布式为1s22s22p3
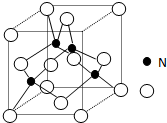
(2)工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式为AlN工业制备X的化学方程式为Al2O3+N2+3C=2AlN+3CO
(3)X晶体中包含的化学键类型为BC(填字母标号)
A.离子键 B.共价键 C.配位键D.金属键 E.氢键
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能
(5)若X的密度为dg/cm3,则晶体中最近的两个N原子的距离为$\frac{\sqrt{2}}{2}$•$\root{3}{\frac{164}{ρ•N{\;}_{A}}}$cm(阿伏加德罗常数的值用NA表示)
分析 (1)氮是7号元素,核外电子数是5,依据构造原理书写电子排布式;
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,所以X的化学式为AlN,根据元素守恒可以写出化学方程式;
(3)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,据此答题;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高;
(5)晶体N原子位于晶胞体对角线的$\frac{1}{2}$处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连的连线为该三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的$\frac{1}{2}$,根据晶胞的密度可以求得晶胞边长,进而求得底面对角线的长度,据此可解题.
解答 解::(1)氮是7号元素,核外电子数是5,核外电子排布式为1s22s22p3,
故答案为:1s22s22p3;
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,所以X的化学式为AlN,氧化铝与氮气和碳在一定条件下反应的化学方程式为Al2O3+N2+3C=2AlN+3CO,
故答案为:AlN;Al2O3+N2+3C=2AlN+3CO;
(3)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,
故答案为:BC;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,
故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(5)晶体N原子位于晶胞体对角线的$\frac{1}{2}$处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连的连线为该三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的$\frac{1}{2}$,根据晶胞的密度ρ=$\frac{\frac{4×27+4×14}{{N}_{A}}}{晶体边{长}^{3}}$,可以求得晶胞边长为$\root{3}{\frac{164}{ρ•N{\;}_{A}}}$cm,
进而求得底面对角线的长度为$\sqrt{2}$•$\root{3}{\frac{164}{ρ•N{\;}_{A}}}$cm,所以晶体中最近的两个N原子的距离为$\frac{\sqrt{2}}{2}$•$\root{3}{\frac{164}{ρ•N{\;}_{A}}}$cm,
故答案为:$\frac{\sqrt{2}}{2}$•$\root{3}{\frac{164}{ρ•N{\;}_{A}}}$.
点评 本题考查了原子核外电子排布图、均摊法晶胞的计算、键能与性质的关系、以及晶胞结构的计算等知识,为高考选作真题,难度较大,其中晶胞的计算是该题的难点.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 1s22s22p3 | B. | ls22s22p63s23p1 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl的水溶液中置换出金属钠 | |
| C. | Li、Na、K、Rb、Cs等碱金属单质都是银白色 | |
| D. | 碱性:LiOH>NaOH>KOH |
| A. | NCl3的电子式: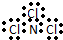 | B. | H- 的结构示意图 | ||
| C. | 含有4个中子的锂原子:74Li | D. | 次氯酸的结构式:H-Cl-O |
| A. | 储氢、释氢过程均无能量变化 | |
| B. | NaHCO3只含离子键 | |
| C. | 储氢过程中,NaHCO3被还原 | |
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
| A. | 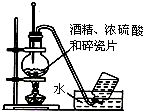 实验室用乙醇制取乙烯 | B. | 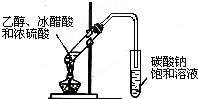 实验室制取乙酸乙酯 | ||
| C. | 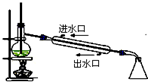 石油分馏 | D. |  实验室制取硝基苯 |
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子总数为0.2 NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 乙二醇与钠的在反应中,每生成1molH2消耗乙二醇1mol | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4 NA |
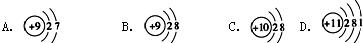
 .
.