题目内容
4.下列化学用语使用正确的是( )| A. | NCl3的电子式: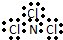 | B. | H- 的结构示意图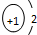 | ||
| C. | 含有4个中子的锂原子:74Li | D. | 次氯酸的结构式:H-Cl-O |
分析 A.NCl3的电子式中N原子最外层达到8电子稳定结构,漏掉了氮原子的一对孤电子对;
B.H-的核电荷数为额1、最外层达到2个电子稳定结构;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.次氯酸的中心原子为Cl原子,其分子中不存在氢氯键.
解答 解:A.NCl3中N原子最外层为8个电子,其正确的电子式为: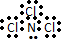 ,故A错误;
,故A错误;
B.H-的核电荷数为1,核外电子总数为2,其结构示意图: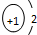 ,故B正确;
,故B正确;
C.含有4个中子的锂原子的质量数为7,该元素符号正确的表示方法为:73Li,故C错误;
D.次氯酸分子中含有1个氧氢键和1个氧氯键,其结构式为:H-O-Cl,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握电子式、离子结构示意图、结构式、元素符号等化学用语的概念及书写原则,D为易错点,注意次氯酸的中心原子为O.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
15.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦的化合物的电子式 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.
16.在光照下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是( )
| A. | HCl | B. | CH3Cl | C. | CHCl3 | D. | CCl4 |
13.有机物分子中,若有1个碳原子用4个单键与4个互不相同的原子或原子团相连,这样的碳原子称为“手性碳”.若烯烃 分子中含有手性碳,该烯烃的一个分子中至少含有的碳原子数是( )
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
14.常温下(I)100mL0.1mol/L的NaA溶液中的离子总物质的量为X,(Ⅱ)100mL 0.1mol/L的NaB溶液中的离子总物质的量为Y.下列推断正确的是( )
| A. | 若X>Y,则酸性:HA>HB | |
| B. | 若X=Y,则HB一定是强酸 | |
| C. | 若酸性:HA<HB,则X和Y关系不确定 | |
| D. | 若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |
 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是: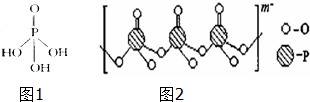 磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空: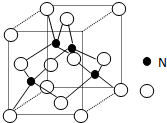 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域