题目内容
14.科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2$?_{释氢}^{储氢}$HCOONa+H2O.下列有关说法正确的是( )| A. | 储氢、释氢过程均无能量变化 | |
| B. | NaHCO3只含离子键 | |
| C. | 储氢过程中,NaHCO3被还原 | |
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
分析 A.储氢释氢是化学变化,化学变化中一定伴随能量变化;
B.NaHCO3晶体中HCO3-中含有共价键;
C.储氢过程中C元素的化合价由+4降低为+2;
D.气体体积与温度和压强有关.
解答 解:A.储氢释氢NaHCO3+H2 $?_{释氢}^{储氢}$HCOONa+H2O,储氢、释氢过程都是化学变化,化学变化中一定伴随能量变化,故A错误;
B.NaHCO3晶体是离子晶体,由Na+与HCO3-构成,HCO3-中含有共价键,故B错误;
C.储氢过程中C元素的化合价由+4降低为+2,NaHCO3被还原,故C正确;
D.储氢释氢NaHCO3+H2 $?_{释氢}^{储氢}$HCOONa+H2O,释氢过程中,每消耗0.1molH2O放出0.1mol的H2,只有在标准状况下0.1mol的H2为2.24L,该题未指明在标准状况下,所以0.1mol的H2不一定为2.24L,故D错误;
故选C.
点评 本题以储氢方法为载体考查了氧化还原反应、化学反应中能量变化、化学键、气体摩尔体积的应用条件等,题目综合性较强,平时注意基础知识的全面掌握,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
4.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式的1s22s2的Y原子 | |
| B. | 原子核外L层仅有两个电子的X原子与原子核外M层仅有两个电子的Y原子 | |
| C. | 2p轨道只有一个未成对电子的X原子和3P轨道只有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
5.化学与人类生活密切相关.关于下列物质的使用不合理的是( )
| A. | 二氧化硫常用于食品增白 | B. | 碳酸氢钠常用于焙制糕点 | ||
| C. | 醋酸常用于除去水壶内的水垢 | D. | 氢氧化铝常用于治疗胃酸过多 |
2.有4种有机物:
①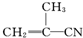 ②
②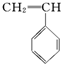 ③
③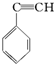 ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为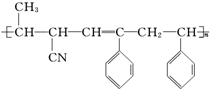 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )
①
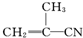 ②
② ③
③ ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
6.已知2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).是工业制H2SO4的一个重要的反应,控制此反应条件,使之向有利于生成SO3的反应方向进行,下列有关叙述错误的是( )
| A. | 使用催化剂(V2O5)可提高该反应的反应速率 | |
| B. | 定期抽走SO3,有利于提高SO3的产率 | |
| C. | 增大O2的浓度,有利于提高SO2的转化率 | |
| D. | 增大SO2的浓度,有利于提高SO2的转化率 |
3.决定化学反应速率的主要因素是( )
| A. | 催化剂 | B. | 温度、压强以及反应物的接触面 | ||
| C. | 反应物的浓度 | D. | 参加反应的物质本身的性质 |
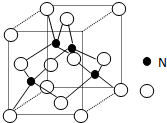 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域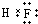 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.