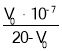题目内容
【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
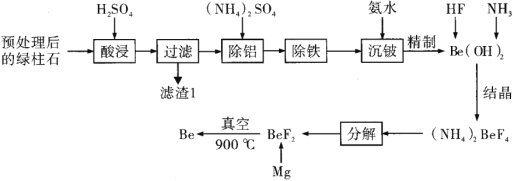
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
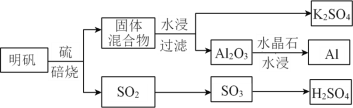
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。
【答案】4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O 四 ⅠA 2 1s22s22p63s23p5 > > < < 3 V形 sp2 CH3COOH存在分子间氢键 16 ![]()
【解析】
明矾和硫混合焙烧生成SO2和固体混合物,用水溶解固体并过滤得到滤渣Al2O3、滤液K2SO4,利用电解Al2O3可制得Al,SO2催化氧化生成SO3,再溶于水可制得硫酸。利用均摊法先确定晶胞的组成,得到晶胞的质量,再结合![]() 计算。
计算。
(1)明矾和硫混合焙烧生成SO2、K2SO4和Al2O3,则结合守恒法,发生反应的化学方程式为4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O;
(2)K的核电荷数为19,核外电子排布式为1s22s22p63s23p64s1,则K位于元素周期表第四周期第ⅠA族;
(3)S的核电荷数为16,价电子轨道表达式为![]() ,则基态S原子核外有2个未成对电子;Cl的核电荷数为17,基态Cl原子核外电子排布式为1s22s22p63s23p5;
,则基态S原子核外有2个未成对电子;Cl的核电荷数为17,基态Cl原子核外电子排布式为1s22s22p63s23p5;
(4)同主族元素,随着原子序数的增加,原子核对核外电子的吸引力减弱,第一电离能减小,则第一电离能:O>S;核外电子排布相同的离子,核电荷数越大,离子半径越小,则离子半径:Cl->K+;钾离子半径大于铝离子半径,铝离子半径大于氧离子半径,所以Al2O3的熔点高于KCl的熔点,故熔点:KCl<Al2O3;元素的非金属性越强,元素最高价氧化物的水化物的酸性越强,因为非金属性Cl>S,则酸性:H2SO4<HClO4;
(5)SO2的价层电子对个数是2+![]() =3,S原子为sp2杂化,孤对电子数是1,该分子为结构为V形;SO3中硫原子价层电子对个数是3+
=3,S原子为sp2杂化,孤对电子数是1,该分子为结构为V形;SO3中硫原子价层电子对个数是3+![]() =3,无孤对电子,采用杂化方式sp2;
=3,无孤对电子,采用杂化方式sp2;
(6)乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
(7)Al单质为面心立方晶体,以顶点Al原子研究,其配原子处于面心位置,顶点为8个晶胞共用,面心为2个晶胞共用,则晶胞中Al原子数目=8×![]() +6×
+6×![]() =4,Al原子总质量=4×
=4,Al原子总质量=4×![]() g
g![]() g)÷(0.405×10-7 cm)3=
g)÷(0.405×10-7 cm)3=![]() gcm-3。
gcm-3。