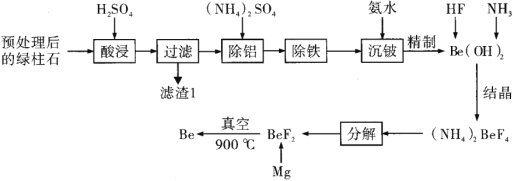
ЬтФПФкШн
ЁОЬтФПЁПюызїЮЊвЛжжаТаЫВФСЯШевцБЛжиЪгЃЌЪЧдзгФмЁЂЛ№М§ЁЂЕМЕЏЁЂКНПевдМАвБН№ЙЄвЕжаВЛПЩШБЩйЕФБІЙѓВФСЯЁЃюыМАЦфЛЏКЯЮяДѓЖрОпгаЖОадЁЃШчЭМЪЧвдвЛжжвбОдЄДІРэКѓЕФКЌюыПѓТЬжљЪЏ(жївЊКЌга![]() ЃЌ
ЃЌ![]() ЃЌ
ЃЌ![]() ЃЌ
ЃЌ![]() КЭ
КЭ![]() ЕШ)ЮЊдСЯжЦШЁЕЅжЪюыЕФЙЄвеСїГЬЃК
ЕШ)ЮЊдСЯжЦШЁЕЅжЪюыЕФЙЄвеСїГЬЃК
вбжЊЃКi.юыКЭТСЕФЛЏбЇаджЪЯрЫЦЃЛ
ii.ТШЛЏюыдкШкШлЬЌЪБНЯФбЕчРыЃЛ
iii.Be(OH)2дк![]() ЪБЛсШмНтЃЛ
ЪБЛсШмНтЃЛ
iV.![]() ЁЃ
ЁЃ
(1)ТЫдќ1ЕФжївЊГЩЗжЪЧ________ЁЃ
(2)дкЁАГ§ТСЁБЙ§ГЬжаТСЛсвдТСяЇЗЏ![]() ЕФаЮЪНЮіГіЃЌдђДЫЙ§ГЬжаЩњГЩТСяЇЗЏЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
ЕФаЮЪНЮіГіЃЌдђДЫЙ§ГЬжаЩњГЩТСяЇЗЏЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃ
(3)ЁАГ§ЬњЁБЙ§ГЬвЊЧѓВЛв§ШыаТЕФдгжЪЃЌЦфВйзїгІЮЊ________ЁЃ
(4)дкЁАГСюыЁБЙ§ГЬжаЃЌШєИФЮЊМгШыЙ§СПЕФ![]() ШмвКЃЌдђюыЕФДцдкаЮЪНЪЧ________(ЬюРызгЗћКХ)ЁЃ
ШмвКЃЌдђюыЕФДцдкаЮЪНЪЧ________(ЬюРызгЗћКХ)ЁЃ
(5)дкЁАЗжНтЁБЙ§ГЬжаВњЩњЕФ![]() бЬЦјЛсЗЂЩњЗДгІЃК
бЬЦјЛсЗЂЩњЗДгІЃК![]() ЃЌПЩгУ
ЃЌПЩгУ![]() ДњЬц
ДњЬц![]() гУгкЕёПЬВЃСЇЃЌЗДгІЙ§ГЬжага
гУгкЕёПЬВЃСЇЃЌЗДгІЙ§ГЬжага![]() ЩњГЩЃЌЧыаДГіДЫЗДгІЕФЛЏбЇЗНГЬЪНЃК________ЁЃ
ЩњГЩЃЌЧыаДГіДЫЗДгІЕФЛЏбЇЗНГЬЪНЃК________ЁЃ
(6)ЙЄвежаВЩгУЗњЛЏюыУОШШЛЙдЗЈжЦШЁюыашвЊецПеЛЗОГЕФдвђЪЧ________ЁЃТШЛЏюыШлбЮЕчНтЗЈвВПЩвджЦШЁюыЃЌЕЋЪЧдкЕчНтЙ§ГЬжаашвЊМгШыЕШСПЕФ![]() ЃЌМгШы
ЃЌМгШы![]() ЕФзїгУЪЧ________ЁЃ
ЕФзїгУЪЧ________ЁЃ
(7)юыЭвђОпгаСМКУЕФЕМЕчадЁЂЕМШШадЁЂФЭИЏЪДадЁЂФЭШШГхЛїадвдМАЮоДХадЁЂЮоЛ№ЛЈЕШЬиадЖјГЩЮЊзюЮЊЙуЗКЪЙгУЕФвЛжжюыКЯН№ЁЃШєТЬжљЪЏжа![]() ЕФКЌСПЮЊa%ЃЌЩЯЪіЙЄвеСїГЬжа
ЕФКЌСПЮЊa%ЃЌЩЯЪіЙЄвеСїГЬжа![]() ЕФВњТЪЮЊb%ЃЌдђ1tТЬжљЪЏРэТлЩЯПЩвдЩњВњКЌ2%BeЕФюыЭКЯН№________tЁЃ
ЕФВњТЪЮЊb%ЃЌдђ1tТЬжљЪЏРэТлЩЯПЩвдЩњВњКЌ2%BeЕФюыЭКЯН№________tЁЃ
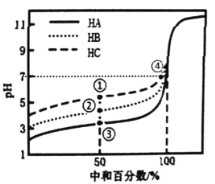
(8)ЙЄвеСїГЬжаВњЩњЕФКЌга![]() ЕФЗЯЫЎПЩвдгУЪЏЛвжаКЭЁЊЁЊЩњЮяОЛЛЏЗЈНјааОЛЛЏЁЃВЛЭЌЕФpHжЕКЭЮТЖШЯТЃЌЪЏЛвжаКЭЁЊЁЊЩњЮяОЛЛЏЗЈОЛЛЏКѓШмвКжаЕФюыЕФХЈЖШШчЭМЫљЪОЃЌдђЮЊСЫМѕЩйЮлШОЃЌзюгІбЁгУЕФpHЗЖЮЇКЭЮТЖШЗжБ№ЪЧ________(ЬюађКХ)ЁЃ
ЕФЗЯЫЎПЩвдгУЪЏЛвжаКЭЁЊЁЊЩњЮяОЛЛЏЗЈНјааОЛЛЏЁЃВЛЭЌЕФpHжЕКЭЮТЖШЯТЃЌЪЏЛвжаКЭЁЊЁЊЩњЮяОЛЛЏЗЈОЛЛЏКѓШмвКжаЕФюыЕФХЈЖШШчЭМЫљЪОЃЌдђЮЊСЫМѕЩйЮлШОЃЌзюгІбЁгУЕФpHЗЖЮЇКЭЮТЖШЗжБ№ЪЧ________(ЬюађКХ)ЁЃ
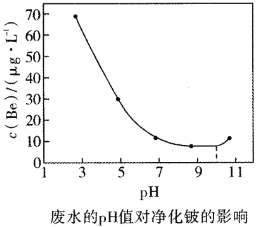
A.9~11ЃЌ30Ёц B.7~10ЃЌ30Ёц C.8~11ЃЌ35Ёц
ЁОД№АИЁПSiO2 (NH4)2SO4+Al2(SO4)3+24H2O=2[(NH4)Al(SO4)2ЁЄ12H2O] дкТЫвКжаМгШыЪЪСПH2O2ЃЌдйМгЪЪСПАБЫЎЕїећЕФpHЁн3 BeO22- SiO2+4NH4HF2=SiF4Ёќ+4NH4F+2H2O ЗРжЙBeКЭMgБЛбѕЛЏ діЧПШлШкбЮЕФЕМЕчад 1.8ЁС10-3ab B
ЁОНтЮіЁП
гУЯЁСђЫсШмНтКЌюыПѓТЬжљЪЏЃЌЦфжаBeOЁЂAl2O3ЁЂFe2O3КЭFeOОљФмШмгкЫсЃЌЖјSiO2ВЛШмгкЫсЧвВЛШмгкЫЎЃЌОЙ§ТЫЃЌТЫдќЂёЮЊSiO2ЃЌЖјТЫвКжажївЊКЌгаBe2+ЁЂAl3+ЁЂFe3+ЁЂFe2+МАЙ§СПЕФЫсЃЌТЫвКжаМгШы(NH4)2SO4гаТСяЇЗЏ[(NH4)Al(SO4)2ЁЄ12H2O]ЮіГіЃЌОЙ§Й§ТЫГ§ШЅЃЌДяЕНГ§ТСЕФФПЕФЃЌМЬајЯђЫљЕУТЫвКжаМгШыМгШыЪЪСПH2O2бѕЛЏFe2+ЃЌдйМгЪЪСПАБЫЎЕїећЕФpHЃЌЪЙШмвКжаFe3+ЭъШЋзЊЛЏЮЊFe(OH)3ГСЕэЃЌдйЙ§ТЫГ§ШЅЃЌДяЕНГ§ЬњЕФФПЕФЃЌдйЯђТЫвКжаМгШыАБЫЎЁЂHFЃЌЕУЕН(NH4)2BeF4ЃЌИпЮТЗжНтЕУЕНBeF2ЃЌМгШыУОдкИпЮТЯТЗДгІЩњГЩBeЃЌвдДЫНтД№ИУЬтЁЃ
(1)гЩЗжЮіжЊЃЌТЫдќ1ЕФжївЊГЩЗжЪЧSiO2ЃЛ
(2) ЯђКЌAl3+ЕФТЫвКжаМгШы(NH4)2SO4гаТСяЇЗЏ[(NH4)Al(SO4)2ЁЄ12H2O]ЮіГіЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ(NH4)2SO4+Al2(SO4)3+24H2O=2[(NH4)Al(SO4)2ЁЄ12H2O]ЃЛ
(3)вбжЊ![]() ЃЌЕБc(Fe3+)=1ЁС10-5mol/LЪБЃЌc(OH-)=
ЃЌЕБc(Fe3+)=1ЁС10-5mol/LЪБЃЌc(OH-)=![]() mol/L=1ЁС10-11mol/LЃЌДЫЪБШмвКpH=3ЃЛдђЁАГ§ЬњЁБЙ§ГЬвЊЧѓЯШбѕЛЏFe2+ЃЌдйЕїНкШмвКpHЁн3ЃЌЪЙFe3+ЭъШЋзЊЛЏЮЊFe(OH)3ГСЕэЃЌдкВЛв§ШыаТЕФдгжЪЕФЧАЬсЯТЃЌе§ШЗВйзїгІЮЊЯђТЫвКжаМгШыЪЪСПH2O2ЃЌдйМгЪЪСПАБЫЎЕїећЕФpHЁн3ЃЛ
mol/L=1ЁС10-11mol/LЃЌДЫЪБШмвКpH=3ЃЛдђЁАГ§ЬњЁБЙ§ГЬвЊЧѓЯШбѕЛЏFe2+ЃЌдйЕїНкШмвКpHЁн3ЃЌЪЙFe3+ЭъШЋзЊЛЏЮЊFe(OH)3ГСЕэЃЌдкВЛв§ШыаТЕФдгжЪЕФЧАЬсЯТЃЌе§ШЗВйзїгІЮЊЯђТЫвКжаМгШыЪЪСПH2O2ЃЌдйМгЪЪСПАБЫЎЕїећЕФpHЁн3ЃЛ
(4) Be(OH)2ФмШмгкNaOHШмвКЃЌдђ ЁАГСюыЁБЙ§ГЬжаЃЌШєМгШыЙ§СПЕФ![]() ШмвКЃЌBe(OH)2ЛсШмгкNaOHЩњГЩNaBeO2ЃЌМДюыЕФДцдкаЮЪНЪЧBeO22-ЃЛ
ШмвКЃЌBe(OH)2ЛсШмгкNaOHЩњГЩNaBeO2ЃЌМДюыЕФДцдкаЮЪНЪЧBeO22-ЃЛ
(5) гУ![]() ДњЬц
ДњЬц![]() гУгкЕёПЬВЃСЇЃЌМДSiO2ФмгыNH4HF2ЗДгІЩњГЩSiF4КЭNH4FЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊSiO2+4NH4HF2=SiF4Ёќ+4NH4F+2H2OЃЛ
гУгкЕёПЬВЃСЇЃЌМДSiO2ФмгыNH4HF2ЗДгІЩњГЩSiF4КЭNH4FЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊSiO2+4NH4HF2=SiF4Ёќ+4NH4F+2H2OЃЛ
(6)BeКЭMgвздкПеЦјжаБЛбѕЦјбѕЛЏЃЌдђВЩгУЗњЛЏюыУОШШЛЙдЗЈжЦШЁюыашвЊецПеЛЗОГЃЌДяЕНЗРжЙBeКЭMgБЛбѕЛЏЕФФПЕФЃЛТШЛЏюыдкШкШлЬЌЪБНЯФбЕчРыЃЌдкЕчНтЙ§ГЬжаашвЊМгШыЕШСПЕФNaClЃЌПЩдіЧПШлШкбЮЕФЕМЕчадЃЛ
(7)ИљОндзгЪиКуЃЌвРОнвбжЊЬѕМў1tИУТЬжљЪЏРэТлЩЯФмЩњВњКЌЖЦСП2%ЕФЖЦЭЬЈН№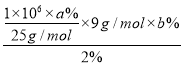 =1.8ЁС103abg=1.8ЁС10-3abtЃЛ
=1.8ЁС103abg=1.8ЁС10-3abtЃЛ
(8)ЕБШмвКpHдк7~10зѓгвЁЂЮТЖШ30ЁцЪБШмвКжаc(Be)зюЕЭЃЌМДОЛЛЏаЇЙћзюКУЃЌЙЪД№АИЮЊBЁЃ

ЁОЬтФПЁПKЁЂAlЁЂCuЁЂHЁЂCЁЂOЁЂSЁЂClЪЧГЃМћЕФАЫжждЊЫиЁЃ
(1)ДгУїЗЏ[KAl(SO4)2ЁЄ12H2O]жЦБИ AlЁЂK2SO4КЭH2SO4ЕФЙ§ГЬШчЯТЭМЫљЪОЃК
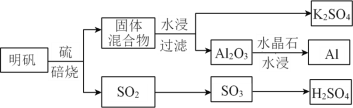
БКЩеУїЗЏЕФЛЏбЇЗНГЬЪНЮЊ_________________________________________________ЁЃ
(2)KЮЛгкдЊЫижмЦкБэЕк________жмЦкЕк________зхЁЃ
(3)SЕФЛљЬЌдзгКЫЭтга________ИіЮДГЩЖдЕчзгЃЛClЕФЛљЬЌдзгКЫЭтЕчзгХХВМЪНЮЊ____________ЁЃ
(4)гУЁАЃОЁБЛђЁАЃМЁБЬюПеЃК
ЕквЛЕчРыФм | РызгАыОЖ | ШлЕу | Ысад |
O____S | ClЃ____KЃЋ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2ЕФМлВуЕчзгЖдИіЪ§ЪЧ________ЃЌИУЗжзгЮЊНсЙЙЮЊ________ЃЛSO3жаСђдзгВЩгУдгЛЏЗНЪНЮЊ___________ЁЃ
(6)аТжЦБИЕФCu(OH)2ПЩНЋввШЉбѕЛЏГЩввЫсЃЌЖјздЩэЛЙдГЩCu2OЁЃввЫсЕФЗаЕуУїЯдИпгкввШЉЃЌЦфжївЊдвђЪЧ____________________ЁЃCu2OЮЊАыЕМЬхВФСЯЃЌдкЦфСЂЗНОЇАћФкВПга4ИібѕдзгЃЌЦфгрбѕдзгЮЛгкУцаФКЭЖЅЕуЃЌдђИУОЇАћжага________ИіЭдзгЁЃ
(7)AlЕЅжЪЮЊУцаФСЂЗНОЇЬхЃЌЦфОЇАћВЮЪ§a=0.405 nmЃЌСаЪНБэЪОAlЕЅжЪЕФУмЖШ__________gЁЄcmЃ3(СаГіМЦЫуЪНзгЃЌВЛБиМЦЫуГіНсЙћ)ЁЃ