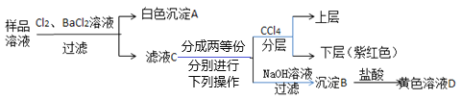
题目内容
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图:
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图:
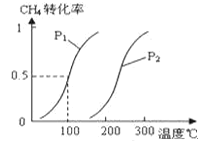
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为______。
②在其它条件不变的情况下升高温度,化学平衡常数将_______(填“增大”“减小”或“不变”)。
③图中的P1_____P2(填“<”、“>”或“=”),100℃时平衡常数为________。
④保持反应体系为100℃,5min后再向容器中充入H2O、H2各0.5mol,化学平衡将向_____移动(填“向左”“向右”或“不”)。
(2)在压强为0.1MPa条件下,将amolCO与3amol H2的混合气体在催化剂作用下能自发发生反应Ⅱ:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H_____0,△S_____0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可以提高CO转化率的是______。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1molCO和3molH2
【答案】0.030molL﹣1min﹣1 增大 < 2.25×10﹣2 向左 < < BD
【解析】
(1)①根据图像,100℃平衡时甲烷的转化率,求出△c(CH4),根据v=![]() 计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);②根据“定一议二”的方法分析判断;③根据“定一议二”的方法分析判断;根据三段式,结合平衡常数K=
计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);②根据“定一议二”的方法分析判断;③根据“定一议二”的方法分析判断;根据三段式,结合平衡常数K=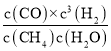 计算;④保持反应体系为100℃,5min后再向容器中冲入H2O、H2各0.5mol,根据浓度商与平衡常数的相对大小的判断;
计算;④保持反应体系为100℃,5min后再向容器中冲入H2O、H2各0.5mol,根据浓度商与平衡常数的相对大小的判断;
(2)①混合气体在催化剂作用下能自发反应生成甲醇,结合方程式和△G=△H-T△S<0分析判断;
②容器容积不变,增加CO的转化率,需要平衡向正反应移动,根据外界条件对平衡的影响分析判断。
(1)①由100℃平衡CH4的转化率为0.5可知,消耗CH4为1mol×0.5=0.5mol,平衡时甲烷的浓度变化量为![]() =5×10-2mol/L,根据甲烷与氢气的计量数关系,则:v(H2)=3v(CH4)=3×
=5×10-2mol/L,根据甲烷与氢气的计量数关系,则:v(H2)=3v(CH4)=3×![]() =0.030molL-1min-1,故答案为:0.030molL-1min-1;
=0.030molL-1min-1,故答案为:0.030molL-1min-1;
②通过图像可知,当压强为P1时,升高温度,甲烷的转化率增大,平衡正向移动,所以升高温度,平衡常数增大,故答案为:增大;
③由图可知,温度相同时,到达平衡时,压强为P1的CH4转化率高,正反应为气体体积增大的反应,增大压强,平衡向逆反应方向移动,甲烷的转化率降低,故压强P1<P2,
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
初始浓度:0.1 0.2 0 0
变化浓度:0.05 0.05 0.05 0.15
平衡浓度:0.05 0.15 0.05 0.15
100℃时平衡常数K=![]() =2.25×10-2,故答案为:<;2.25×10-2;
=2.25×10-2,故答案为:<;2.25×10-2;
④保持反应体系为100℃,5min后再向容器中冲入H2O、H2各0.5mol,Qc=![]() =4×10-2>K,所以平衡向左移动,故答案为:向左;
=4×10-2>K,所以平衡向左移动,故答案为:向左;
(2)①CO(g)+2H2(g)![]() CH3OH(g)正反应是气体物质的量减小的反应,反应的△S<0,混合气体在催化剂作用下能自发反应生成甲醇,根据△G=△H-T△S<0,说明△H<0,即正反应是放热反应,故答案为:<;<;
CH3OH(g)正反应是气体物质的量减小的反应,反应的△S<0,混合气体在催化剂作用下能自发反应生成甲醇,根据△G=△H-T△S<0,说明△H<0,即正反应是放热反应,故答案为:<;<;
②A.该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,CO的转化率降低,故A错误;B.将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,CO的转化率增加,故B正确;C.充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,CO的转化率不变,故C错误;D.再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,CO的转化率增加,故D正确;故答案为:BD。

【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
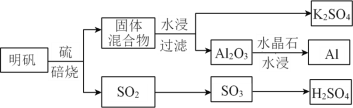
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
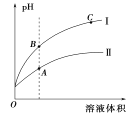
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-
【题目】“地沟油”泛指生活中产生的、不宜继续食用的油脂。地沟油经脱胶、洗涤、脱色等预处理,用来制备脂肪酸钠(RCOONa),在消除危害的同时,还可用于处理含Cu2+的废水。
已知:2RCOO-+Cu2+![]() (RCOO)2Cu
(RCOO)2Cu
(1)可利用活性炭对地沟油进行脱色处理,这利用了活性炭的____________性。
(2)取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。
序号 | 试剂 | 温度 | 时间 | 水解率 |
a | 20 mL3 mol/L H2SO4 | 95℃ | 3小时 | 52.1% |
b | 20 mL 6 mol/LNaOH | 70℃ | 1.5 | 97.7% |
①实验a中,三油酸甘油酯水解的产物是____________(填物质名称)。
②对比实验a、b可以得到的结论有____________(写出2条)。
(3)将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。

①RCOONa属于____________(填“离子化合物”或“共价化合物”)。
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为____________。