题目内容
【题目】根据要求回答下列问题。
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧CO2
(1)写出Na2O2的电子式________,存在的化学键类型有________________。
(2)写出HClO电子式________________,写出CO2的结构式_______。
(3)含有共价键的离子化合物是_______(填序号)
(4)用电子式表示CaBr2的形成过程_________________________________ 。
【答案】![]() 离子键、非极性键(共价键)
离子键、非极性键(共价键) ![]() O=C=O ③⑤⑥
O=C=O ③⑤⑥ ![]()
【解析】
(1)Na2O2为离子化合物,含离子键、O-O非极性键;
(2)次氯酸是共价化合物,氯原子、氢原子分别与氧原子形成共价键,据此书写电子式,CO2的电子式为![]() ,据此书写结构式;
,据此书写结构式;
(3)一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,只含共价键的化合物为共价化合物,据此分析解答;
(4) CaBr2为离子化合物,只含离子键,据此书写CaBr2的形成过程。
(1)过氧化钠是离子化合物,由钠离子与过氧根离子构成,过氧化钠的电子式为![]() ,含离子键和O-O非极性共价键,故答案为:
,含离子键和O-O非极性共价键,故答案为:![]() ;离子键和非极性共价键;
;离子键和非极性共价键;
(2)HClO为共价化合物,电子式是![]() ,CO2的电子式为
,CO2的电子式为![]() ,结构式为O=C=O,故答案为:
,结构式为O=C=O,故答案为:![]() ;O=C=O;
;O=C=O;
(3)①CaBr2为离子化合物,只含离子键,②H2O为共价化合物,只含共价键,③NH4Cl为离子化合物,含离子键和共价键,④H2O2为共价化合物,只含共价键,⑤Na2O2为离子化合物,含离子键和共价键,⑥Ca(OH)2为离子化合物,含离子键和共价键,⑦HClO为共价化合物,只含共价键,⑧CO2为共价化合物,只含共价键,其中含有共价键的离子化合物是③⑤⑥,故答案为:③⑤⑥;
(4) CaBr2为离子化合物,只含离子键,CaBr2的形成过程用电子式表示为![]() ,故答案为:
,故答案为:![]() 。
。

【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
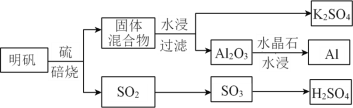
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。