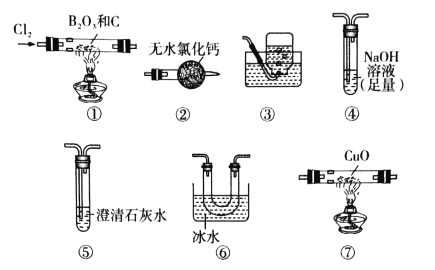
题目内容
【题目】我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
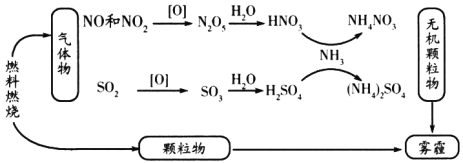
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________(写化学式)。
(2)图中物质溶于水溶液呈碱性的是________。
(3)写出SO2转化为SO3的化学方程式________________________。
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方程式表示)。
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________。
【答案】![]() 、
、![]() 、
、![]()
![]()
![]()
![]()
![]()
![]()
【解析】
本题将氮的氧化物、硫的氧化物和环境保护相结合,图中表示将空气中的![]() 、
、![]() 和
和![]() 转化为硝酸、硫酸,再和氨气反应得到铵盐的过程,铵盐是一种优质的氮肥,实现了污染物的二次利用。
转化为硝酸、硫酸,再和氨气反应得到铵盐的过程,铵盐是一种优质的氮肥,实现了污染物的二次利用。
(1)酸性氧化物是能与碱反应得到盐和水的氧化物,符合要求的有![]() 、
、![]() 和
和![]() ;
;
(2)图中物质溶于水呈碱性的只有![]() ;
;
(3)二氧化硫在催化剂存在可以转化为三氧化硫:![]() ;
;
(4)氨气经催化氧化可以形成一氧化氮:![]() ;
;
(5)浓硝酸见光或受热时易分解,因此要保存在棕色试剂瓶中:![]() ;
;
(6)氨气中的氮为-3价,一氧化氮中的氮为+2价,因此二者可以在一定条件下发生归中反应得到氮气:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
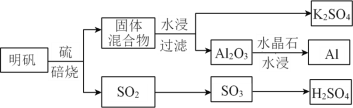
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
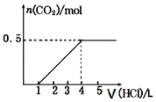
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
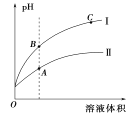
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-