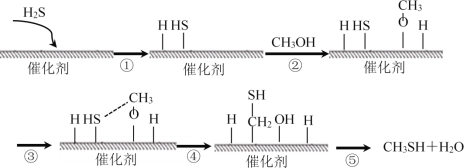
题目内容
【题目】按照物质的树状分类和交叉分类,硫酸应属于____________
①酸 ②化合物③含氧酸④电解质⑤能导电的纯净物⑥二元酸⑦混合物
A.①③④⑤⑥ B.①②③④⑥ C.①②③⑤⑥⑦D.②③⑤⑥⑦
【答案】B
【解析】
①硫酸电离时生成的阳离子都是氢离子,从性质分类属于酸,故①正确;
②![]() 由氢元素、硫元素、氧元素三种元素组成的纯净物,属于化合物,故②正确;
由氢元素、硫元素、氧元素三种元素组成的纯净物,属于化合物,故②正确;
③![]() 由氢元素、硫元素、氧元素三种元素组成,属于含氧酸,故③正确;
由氢元素、硫元素、氧元素三种元素组成,属于含氧酸,故③正确;
④![]() 的水溶液能够导电,
的水溶液能够导电,![]() 属于电解质,故④正确;
属于电解质,故④正确;
⑤硫酸中没有自由移动的离子,不能导电,故⑤错误;
⑥1mol![]() 可电离出2mol氢离子属于二元酸,故⑥正确;
可电离出2mol氢离子属于二元酸,故⑥正确;
⑦![]() 由氢元素、硫元素、氧元素三种元素组成的纯净物,不是混合物,故⑦错误;
由氢元素、硫元素、氧元素三种元素组成的纯净物,不是混合物,故⑦错误;
故答案为:B。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
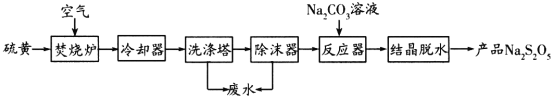
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
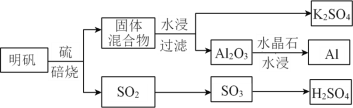
焙烧明矾的化学方程式为_________________________________________________。
(2)K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能 | 离子半径 | 熔点 | 酸性 |
O____S | Cl-____K+ | KCl____Al2O3 | H2SO4____HClO4 |
(5)SO2的价层电子对个数是________,该分子为结构为________;SO3中硫原子采用杂化方式为___________。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。