题目内容
10.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(S2-)=0.1 mol•L-1的溶液中:K+、Cu2+、SO42-、Cl- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
分析 A.pH=1的溶液,显酸性;
B.离子之间结合生成沉淀;
C.c(H+)/c(OH-)=1012的溶液,显酸性;
D.水电离的c(H+)=1×10-14mol•L-1的溶液,为酸或碱溶液.
解答 解:A.pH=1的溶液,显酸性,Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,故A错误;
B.Cu2+、S2-结合生成沉淀,不能大量共存,故B错误;
C.c(H+)/c(OH-)=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故C正确;
D.水电离的c(H+)=1×10-14mol•L-1的溶液,为酸或碱溶液,HCO3-与酸、碱均反应,一定不能大量,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
20.现有以下5种说法:①胶体带电是电泳的前提条件;
②盐酸和食醋既是化合物又是酸;
③氯酸、烧碱、纯碱依次分别为酸、碱、盐;
④古代的青铜器、越王勾践宝剑等均是合金;
⑤溶液包括胶体等分散系;
⑥根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O 可知:H3PO3是三元酸.
其中错误的是( )
②盐酸和食醋既是化合物又是酸;
③氯酸、烧碱、纯碱依次分别为酸、碱、盐;
④古代的青铜器、越王勾践宝剑等均是合金;
⑤溶液包括胶体等分散系;
⑥根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O 可知:H3PO3是三元酸.
其中错误的是( )
| A. | ①②⑤⑥ | B. | ①②③④⑤ | C. | ③④ | D. | ②⑤ |
1.下列实验操作中错误的是( )
| A. | 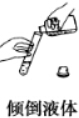 | B. | 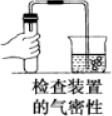 | C. | 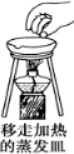 | D. | 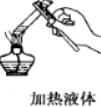 |
5.化学在生产和日常生活中有着重要的作用.下列说法中不正确的是( )
| A. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道泄漏情况 | |
| D. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 |
15.将一定量的铁粉完全溶解于某浓度的硝酸中,反应后收集到NO2和NO的混合气体,下列说法正确的是( )
| A. | 反应后生成的盐只有Fe(NO3)2 | B. | 反应后生成的盐只有Fe(NO3)3 | ||
| C. | 反应后生成的盐为Fe(NO3)2和Fe(NO3)3 | D. | 以上三种情况都有可能 |
8.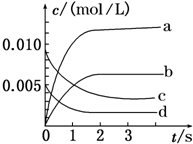 在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
(1)在第4s时,X的转化率为多少?
(2)如图中表示Z变化曲线的是b,用Y表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
 在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(X)/mol | 0.020 | 0.010 | 0.008 | 0.008 | 0.008 | 0.008 |
(2)如图中表示Z变化曲线的是b,用Y表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: