题目内容
18.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同周期也不在同主族,D的氢化物和最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水.据此回答下列问题:(1)元素C在元素周期表中的位置是第三周期第ⅢA族,B的最高价氧化物对应的水化物与D的最高价氧化物的水化物混合反应的离子方程式为H++OH-═H2O
(2)D的氢化物形成的浓溶液可以使高锰酸钾溶液褪色反应的离子方程式为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为次氯酸钙.它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O
(4)工业上制取D单质方法的名称是氯碱工业,反应的离子方程式是Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
分析 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,则A为O元素;B、C、D同周期,由原子序数可知位于第三周期,D的氢化物和最高价氧化物对应的水化物均为强酸,则D为Cl,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水,应是氢氧化铝与强酸、强碱之间的反应,故B为Na、C为Al;E和其他元素既不在同周期也不在同主族,则E为Ca,据此解答.
解答 解:A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,则A为O元素;B、C、D同周期,由原子序数可知位于第三周期,D的氢化物和最高价氧化物对应的水化物均为强酸,则D为Cl,B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水,应是氢氧化铝与强酸、强碱之间的反应,故B为Na、C为Al;E和其他元素既不在同周期也不在同主族,则E为Ca.
(1)元素C为Al,在元素周期表中的位置是:第三周期第ⅢA族,B、D的最高价氧化物对应的水化物分别为NaOH、HClO4,二者反应的离子方程式为:H++OH-═H2O,
故答案为:第三周期第ⅢA族;H++OH-═H2O;
(2)D的氢化物为HCl,形成的浓HCl溶液可以使高锰酸钾溶液褪色,反应的离子方程式为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(3)一种盐中O、Cl、Ca三种元素的原子个数比为2:2:1,该盐为Ca(ClO)2,名称为:次氯酸钙,Ca(ClO)2溶液与HCl水溶液反应可生成氯气,该反应的离子方程式为:ClO-+2H++Cl-═Cl2↑+H2O,
故答案为:次氯酸钙;ClO-+2H++Cl-═Cl2↑+H2O;
(4)工业上制取氯气单质方法的名称是:氯碱工业,反应的离子方程式是:Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:氯碱工业;Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,需要学生熟练掌握基础知识,难度中等.

| A. | 向溴的煤油溶液里加入苯后振荡 | B. | 向溴水中加入四氯化碳后振荡 | ||
| C. | 向硫的二硫化碳溶液里加水后振荡 | D. | 向碘水里加入酒精后振荡 |
| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 常温下$\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol•L-1的溶液中Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol•L-1AlCl3溶液中可能大量存在[Al(OH)4]-、K+、CO32- |
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(S2-)=0.1 mol•L-1的溶液中:K+、Cu2+、SO42-、Cl- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| A. | 一定含有SO42- | B. | 一定同时含有Ag+和SO42- | ||
| C. | 一定含有Ag+ | D. | Ag+或SO42-至少含有一种 |
CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{沉淀剂a}$沉淀A.
| A. | 沉淀A只有Cr(OH)3 | |
| B. | 第①步平衡体系中,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 | |
| C. | 第②步中,还原0.1mol Cr2O72-需要45.6gFeSO4 | |
| D. | 第③步沉淀剂a可以使用NaOH等碱性物质 |
 、
、 .
.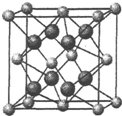 氟在自然界中常以CaF2的形式存在.
氟在自然界中常以CaF2的形式存在.