题目内容
9.H2R属于二元弱酸.已知NaHR的水溶液呈弱酸性,请用必要的化学用语和简要的文字说明其呈弱酸性的原因HR-存在电离:HR-?H++R2-,使溶液呈酸性;HR-存在水解:HR-+H2O?H2R+OH-,使溶液呈碱性;HR-的电离强于水解,所以溶液呈酸性.
分析 H2R属于二元弱酸.已知NaHR的水溶液呈弱酸性,是因为溶液中HR-离子电离程度大于水解程度分析判断.
解答 解:已知NaHR的水溶液呈弱酸性,溶液中NaHR=Na++HR-,HR-存在电离:HR-?H++R2-,使溶液呈酸性;HR-存在水解:HR-+H2O?H2R+OH-,使溶液呈碱性;HR-的电离强于水解,所以溶液呈酸性,
故答案为:HR-存在电离:HR-?H++R2-,使溶液呈酸性;HR-存在水解:HR-+H2O?H2R+OH-,使溶液呈碱性;HR-的电离强于水解,所以溶液呈酸性.
点评 本题考查了盐类水解的原理分析,主要是弱酸酸式盐的电离和水解程度的相对大小比较,掌握基础是解题的关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(S2-)=0.1 mol•L-1的溶液中:K+、Cu2+、SO42-、Cl- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
20.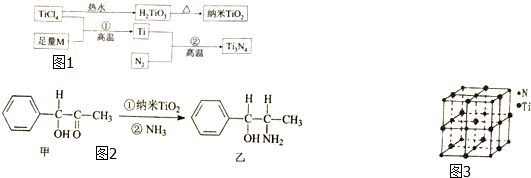 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.
氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.
图1中的M是短周期金属元素,M的部分电离如下表:
(1)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积(填六方最密堆积或面心立方最密堆积)配位数为12.
(2)基态Ti3+中未成对电子数有1个,Ti的基态原子外围电子排布式为4d25s2.
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子式中采取sp2杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(4)有一种氮化钛晶体的晶胞与NaCl相似,如图3所示.该晶体中与N原子距离相等且最近的N原子有12个,该晶体的化学式为TiN.
 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.
氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.图1中的M是短周期金属元素,M的部分电离如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/KJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(2)基态Ti3+中未成对电子数有1个,Ti的基态原子外围电子排布式为4d25s2.
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子式中采取sp2杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(4)有一种氮化钛晶体的晶胞与NaCl相似,如图3所示.该晶体中与N原子距离相等且最近的N原子有12个,该晶体的化学式为TiN.
17.工业废水中的Cr2O72-和CrO42-对生态系统造成很大的损害,其中还原沉淀法是一种常用的处理方法.流程如图,下列说法正确的是( )
CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{沉淀剂a}$沉淀A.
CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{沉淀剂a}$沉淀A.
| A. | 沉淀A只有Cr(OH)3 | |
| B. | 第①步平衡体系中,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 | |
| C. | 第②步中,还原0.1mol Cr2O72-需要45.6gFeSO4 | |
| D. | 第③步沉淀剂a可以使用NaOH等碱性物质 |
4.下列气体的干燥和吸收方法正确的是( )
| A. | 氨气可以用五氧化二磷干燥 | |
| B. | 氮气和氢气反应合成氨气由于反应物转化率较低,用水吸收该混合气体中的氨气不用防倒吸 | |
| C. | 浓硫酸不能干燥硫化氢气体,应该用碱石灰 | |
| D. | 制得的氯气中混有杂质氯化氢气体可用饱和碳酸氢钠溶液吸收 |
14.下列化学实验操作的事故处理方法正确的是( )
| A. | 不慎将浓碱溶液沾在皮肤上,要立即用硫酸或盐酸冲洗 | |
| B. | 氢氧化钠固体洒落到地板上立即用水冲洗 | |
| C. | 酒精灯着火时立即用水扑灭 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
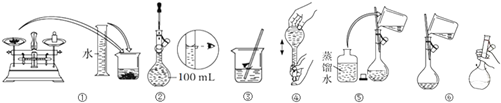
19.关于自来水制蒸馏水实验的叙述不正确的是( )
| A. | 该实验的标准装置包括的玻璃仪器有:酒精灯、圆底烧瓶、直形冷凝管和锥形瓶 | |
| B. | 进行蒸馏实验,装置内部应保持与大气相通以保证安全 | |
| C. | 冷凝水应该从下口进,上口出 | |
| D. | 实验结束时应该先熄灭酒精灯,后停止通冷凝水 |