题目内容
2. 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:(1)电极X的材料是锌(或Zn);电解质溶液Y是AgNO3溶液;
(2)银电极为电池的正极,发生的电极反应为Ag++e-═Ag;
X电极上发生的电极反应为Zn-2e-═Zn2+;
(3)外电路中的电子是从X(或Zn)电极流向Ag电极;
(4)若该电池中两电极的质量均为60g,工作一段时间后,取出锌片洗净干燥后称重,质量为47g,试计算析出银的质量.
分析 根据反应“2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)”分析,在反应中,Zn被氧化,失电子,应为原电池的负极,电极反应为Zn-2e-=Zn2+,则正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极.根据得失电子守恒计算析出银的质量.
解答 解:(1)由反应“2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)”可知,在反应中,Zn被氧化,失电子,应为原电池的负极,
电极反应为Zn-2e-=Zn2+,则正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
电解质溶液为AgNO3 ,
故答案为:锌(或Zn);AgNO3;
(2)正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,X电极为Zn为原电池的负极,锌失电子发生氧化反应,电极反应 Zn-2e-═Zn2+,故答案为:正极; Ag++e-=Ag,Zn-2e-═Zn2+;
(3)原电池中,电子从负极经外电路流向正极,本题中由Zn极经外电路流向Ag极,
故答案为:X(或Zn);Ag.
(4)该原电池中,负极上锌失电子变成锌离子进入溶液,导致质量减少,取出锌片洗净干燥后称重,质量为47g,减少锌的质量=60g-47g=13g,物质的量=$\frac{13g}{65g/mol}$=0.2mol,
根据转移电子相等知,2Ag++2e-=2Ag,Zn-2e-═Zn2+,
2Ag~~Zn
2 1
n 0.2mol
n=0.4mol
析出银的质量=0.4mol×108g/mol=43.2g,
答:析出银的质量43.2g;
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题,题目难度中等.

| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 常温下$\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol•L-1的溶液中Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol•L-1AlCl3溶液中可能大量存在[Al(OH)4]-、K+、CO32- |
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(S2-)=0.1 mol•L-1的溶液中:K+、Cu2+、SO42-、Cl- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
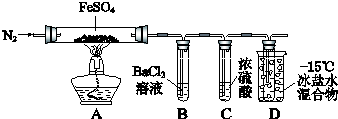
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃.
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
(2)实验③反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(3)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有SO2气体.依据是因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成.
(4)实验④反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
| A. | 一定含有SO42- | B. | 一定同时含有Ag+和SO42- | ||
| C. | 一定含有Ag+ | D. | Ag+或SO42-至少含有一种 |
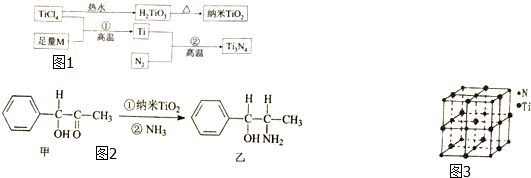 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.
氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应(如图1所示)可以制得Ti3N4和TiO2.图1中的M是短周期金属元素,M的部分电离如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/KJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(2)基态Ti3+中未成对电子数有1个,Ti的基态原子外围电子排布式为4d25s2.
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子式中采取sp2杂化的碳原子数为7,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(4)有一种氮化钛晶体的晶胞与NaCl相似,如图3所示.该晶体中与N原子距离相等且最近的N原子有12个,该晶体的化学式为TiN.