题目内容
6. 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.(1)写出实验室由氯化铵和熟石灰加热制取氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.检验氨气已装满的方法是:用用湿润的红色石蕊试纸靠近集气瓶口试纸靠近集气瓶口,现象为试纸变蓝.
(2)用图装置进行喷泉实验,若加入酚酞,得到红色喷泉,若要得到蓝色喷泉呢,应加入酸碱指示剂石蕊.
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+5O2═4NO+6H2O,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:
4NO+3O2+2H2O═4HNO3
4NO2+1 O2+2H2O═4HNO3
(4)1.28gCu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为0.01mol.
分析 (1)氯化铵和熟石灰在加热条件下反应生成氨气、氯化钙、和水;氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性;
(2)氨气溶于水得到一水合氨溶液是弱碱溶液,遇到酚酞变红色,遇到石蕊试液变为蓝色;
(3)氨气催化氧化生成一氧化氮和水,一氧化氮和氧气混合通入水中恰好反应生成硝酸,二氧化氮和氧气混合通入水中完全吸收得到硝酸,结合原子守恒配平书写化学方程式;
(4)1.28gCu与足量的浓硝酸反应生成的气体为二氧化氮,二氧化氮和氧气通入水中恰好反应物气体剩余生成硝酸,依据化学方程式定量关系计算.
解答 解:(1)氯化铵和熟石灰在加热条件下反应生成氨气、氯化钙、和水,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则氨气已满,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸靠近集气瓶口,试纸变蓝;
(2)氨气溶于水得到一水合氨溶液是弱碱溶液,遇到酚酞变红色,遇到石蕊试液变为蓝色,喷泉实验,若加入酚酞,得到红色喷泉,若要得到蓝色喷泉呢,应加入酸碱指示剂为石蕊试液,
故答案为:石蕊;
(3)氨气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2═4NO+6H2O,一氧化氮和氧气混合通入水中恰好反应生成硝酸,反应的化学方程式为:4NO+3O2+2H2O═4HNO3 ,二氧化氮和氧气混合通入水中完全吸收得到硝酸,反应的化学方程式为:4NO2+O2+H2O═4HNO3 ,
故答案为:5,H2O;3;4,1,2;
(4)1.28gCu物质的量=$\frac{1.28g}{64g/mol}$=0.02mol,与足量的浓硝酸反应生成的气体为二氧化氮,Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,生成0.04mol,二氧化氮和氧气通入水中恰好反应物气体剩余生成硝酸,4NO2+O2+2H2O=4HNO3,需要氧气物质的量为0.01mol,
故答案为:0.01.
点评 本题考查了实验室制备氨气的方法,氨气性质和检验,氮氧化物、硝酸性质的理解应用,化学方程式定量计算分析,掌握基础是关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案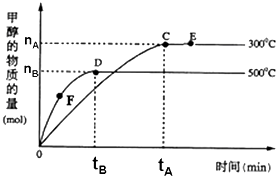 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )| A. | 正反应的△H<0 | |
| B. | 容器中气体的总物质的量E点大于D点 | |
| C. | F点的正反应速率大于逆反应速率 | |
| D. | v(甲醇)=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示500℃时反应在D点的速率 |
| A. | 食盐水 | B. | 烧碱溶液 | C. | 纯碱溶液 | D. | 稀醋酸 |
| A. | 与溴水发生取代,反应产物的结构简式是CH3CBr2CH3 | |
| B. | 一定条件下能与水加成,产物是混合物 | |
| C. | 一定条件下能加聚合成  | |
| D. | 丙烯能使酸性高锰酸钾溶液褪色 |
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
| A. | -241.8 kJ•mol-1 | B. | -20.6kJ•mol-1 | C. | +29.7kJ•mol-1 | D. | +99.7 kJ•mol-1 |
| A. | 水中加入钠:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钙溶液加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜中加入盐酸:OH-+H+═H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
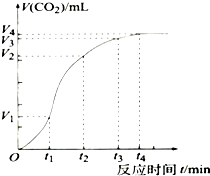 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图).请分析讨论以下问题.