题目内容
下列各选项所述的两个量,前者一定大于后者的是( )
①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径.
①3d轨道的能量和4s轨道的能量;②同一电子层中第一个p轨道与第二个p轨道的能量;③2s和3s的轨道半径;④同一原子的基态和激发态;⑤F元素和O元素的电负性;⑥Mg元素和Al元素的第一电离能;⑦H原子和H+离子的半径.
| A、①⑤⑥⑦ | B、②③⑤ |
| C、②④⑦ | D、全对 |
考点:原子核外电子的能级分布,原子核外电子排布,元素电离能、电负性的含义及应用
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:①根据轨道能量顺序;
②同一电子层中同一能级轨道的能量相等;
③不同能层,同一能级轨道半径随能层的增大而增大;
④同一原子的基态的能量低于激发态;
⑤同周期自左而右电负性增大;
⑥同一周期元素,元素的第一电离能随着原子序数的增大而增大,但同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大;
⑦同种元素的不同离子,核外电子数越大,半径越大.
②同一电子层中同一能级轨道的能量相等;
③不同能层,同一能级轨道半径随能层的增大而增大;
④同一原子的基态的能量低于激发态;
⑤同周期自左而右电负性增大;
⑥同一周期元素,元素的第一电离能随着原子序数的增大而增大,但同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大;
⑦同种元素的不同离子,核外电子数越大,半径越大.
解答:
解:①3d轨道的能量大于4s轨道的能量;
②同一电子层中第一个p轨道与第二个p轨道的能量相等;
③2s的轨道半径小于3s的轨道半径;
④同一原子的基态的能量小于激发态;
⑤F元素电负性大于O元素的电负性;
⑥Mg元素的第一电离能大于Al元素的第一电离能;
⑦H原子的半径大于H+离子的半径;
故选A.
②同一电子层中第一个p轨道与第二个p轨道的能量相等;
③2s的轨道半径小于3s的轨道半径;
④同一原子的基态的能量小于激发态;
⑤F元素电负性大于O元素的电负性;
⑥Mg元素的第一电离能大于Al元素的第一电离能;
⑦H原子的半径大于H+离子的半径;
故选A.
点评:本题考查核外电子排布规律、元素周期律、半径比较、晶格能等,难度不大,注意对规律的理解与运用.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
氯仿可作为局部麻醉剂,常因保存不慎而被空气中的O2氧化,产生剧毒的气体-光气(COCl2):2CHCl3+O2→2COCl2+2HCl.下列说法正确的是( )
| A、上述反应属于取代反应 |
| B、检验氯仿是否变质可选用的试剂是AgNO3溶液 |
| C、CH2Cl2有两种结构,说明CH4是正四面体结构 |
| D、CHCl3是常见的有机溶剂,大量使用对环境无影响 |
下列离子方程式正确的是( )
| A、小苏打溶液中加入醋酸:HCO3-+H+═CO2↑+H2O |
| B、碳酸氢铵溶液和足量氢氧化钠溶液混合:NH4++OH-═NH3?H2O |
| C、NaHS水解:HS-+H2O═S2-+H3O+ |
| D、硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
具有平面结构的有机物(如图)的一氯代物数目共有( )
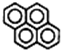

| A、1 | B、2 | C、3 | D、4 |
下列说法不正确的是( )
| A、长期使用阿司匹林会出现水杨酸中毒表现,应立即停药,静脉注射碳酸氢钠溶液 |
| B、红宝石、水晶、钻石的主要成分都是硅酸盐 |
| C、高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 |
| D、石油裂解、煤的气化、海水制镁都包含化学变化 |
下列金属冶炼的原理错误的是( )
A、Cu2S+O2
| ||||
B、Fe2O3+2Al
| ||||
C、MgO+CO
| ||||
D、2Cr+Al2O3
|
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| B、78g苯含有C=C双键的数目为3NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
| D、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
用pH试纸测定某无色溶液的pH时,规范的操作是( )
| A、将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 |
| B、将溶液倒在pH试纸上,跟标准比色卡比较 |
| C、将pH试纸放在干燥的表面皿上,用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸中央,跟标准比色卡比较 |
| D、在试管内放入少量溶液煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |