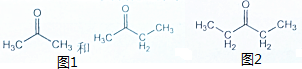
题目内容
9.下列化学反应中既有离子键、极性键、非极性键断裂又有离子键、极性键、非极性键形成的是( )| A. | Cl2 +H2O═HClO+HCl | B. | Na2O+H2O═2NaOH | ||
| C. | 2Na2O2 +2H2O═4NaOH+O2↑ | D. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NaCl+NH3 ↑+H2O |
分析 一般金属元素与非金属元素形成离子键,同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键,以此来解答.
解答 解:A、该反应中没有离子键的形成和断裂,故A不选;
B.该反应中没有非极性共价键的形成,故B不选;
C、2Na2O2+2H2O=4NaOH+O2↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,故C选;
D.该反应中没有非极性键的断裂和形成,故D不选;
故选C.
点评 本题考查化学键和化学反应,明确化学反应的实质为旧键断裂和新键形成及常见物质中的化学键即可解答,注意利用化学键判断的一般规律,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.在环境检测中常用检气管法来测定空气中S02的含量,原理是S02与KIO3发生反应,用一种有机物作指示剂,其可能反应如下(未配平):①KIO3+SO2+H2O→I2+H2SO4+KHSO4 ②KIO3+SO2+H2O→KI+H2SO4,则下列说法正确的是( )
| A. | 检气管法是按照反应①原理设计的 | |
| B. | 检气管法是按照反应②原理设计的 | |
| C. | 反应①②均可以设计成检气管法,但考虑到相同量KIO3①消耗SO2少,所以检气管法是按①设计的 | |
| D. | 反应①②均可以设计成检气管法,但考虑到相同量KIO3②消耗SO2多,所以检气管法是按②设计的 |
5.下列实验方法或试剂保存方法正确的是( )
| A. | 碘中混有沙子,不可以用升华方法提纯 | |
| B. | 金属钠通常保存在煤油里,不能保存在四氯化碳中 | |
| C. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒回试剂瓶中 | |
| D. | 把NaOH固体直接放入容量瓶中,加水到刻度线就配成一定物质的量浓度的NaOH溶液 |
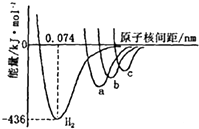 如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.
如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.


 )为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.
)为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.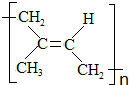 .
.

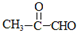 ;
; ;反应类型:酯化反应.
;反应类型:酯化反应.