题目内容
1.化合物A,B,C为同分异构体,A经过臭氧还原水解成CH3-CHO和CH3-CH2-CH2-CH2-CHO,用同样的方法处理B,生成如图1,用同样的方法处理C,得到CH3-CHO和如图2.请写出A,B,C的构造式.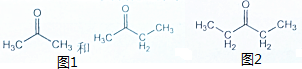
分析 根据A、B、C经过臭氧处理后得到的产物特点可知,该反应原理为:原有机物分子中的碳碳双键断裂变成醛基或羰基,据此采用逆推法,将碳氧双键去掉组成碳碳双键可以分别得到A、B、C的结构简式.
解答 解:根据A、B、C经过臭氧处理后得到的产物特点可知,该反应原理为:原有机物分子中的碳碳双键断裂变成醛基或羰基,据此采用逆推法可知:
A经过臭处理得到CH3-CHO和CH3-CH2-CH2-CH2-CHO,则A的结构简式为:CH3-CH=CH-CH2-CH2-CH2-CH3,
B经过臭氧处理得到丙酮和丁酮,则B的结构简式为:CH3-(CH3)C=(CH3)-CH2-CH3,
C经过臭氧处理后得到CH3-CHO和3-戊酮,则C的结构简式为:CH3-CH=C(-CH2-CH3)-CH2-CH3,
答:A、B、C的结构简式分别为:CH3-CH=CH-CH2-CH2-CH2-CH3、CH3-(CH3)C=(CH3)-CH2-CH3、CH3-CH=C(-CH2-CH3)-CH2-CH3.
点评 本题考查了同分异构体的应用,题目难度中等,明确发生反应原理为解答关键,注意掌握同分异构体的概念及常见有机物结构与性质,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
11.下列有关离子(或物质)的检验及结论,正确的是( )
| A. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体 | |
| B. | 焰色反应实验时,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 欲证明某溶液中含有Fe3+,滴加KSCN溶液,可观察到溶液会变为血红色 | |
| D. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO${\;}_{4}^{2-}$ |
12.以下物质间的每步转化中,有不能通过一步反应实现的是( )
| A. | SO2→SO3→H2SO4 | B. | Al2O3→Al(OH)3→NaAlO2 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | CH2=CH2→CH3CH2OH→CH3CHO |
9.下列化学反应中既有离子键、极性键、非极性键断裂又有离子键、极性键、非极性键形成的是( )
| A. | Cl2 +H2O═HClO+HCl | B. | Na2O+H2O═2NaOH | ||
| C. | 2Na2O2 +2H2O═4NaOH+O2↑ | D. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NaCl+NH3 ↑+H2O |
6.将下列各种液体(乙烯分子中含有一个碳碳双键)分别与溴水混合并震荡,不发生化学反应,静止后混合液分成两层,溴水层几乎无色的是( )
| A. | 氯水 | B. | 乙烯 | C. | 苯 | D. | 碘化钾溶液 |
13.在标准状况下进行甲、乙、丙三组实验.各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体.有关数据记录如表:
试回答:
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量g | 0.255 | 0.385 | 0.459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
10.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、Mg2+、OH-、Cl- | B. | H+、Na+、SO42-、CO32- | ||
| C. | K+、Ag+、Cl-、NO3- | D. | Ca2+、K+、Cl-、NO3- |
17.下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是Ar,最活泼的金属元素是K,最活泼的非金属元素是F.
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++ →
→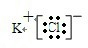 .
.
(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++
 →
→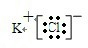 .
.(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |