题目内容
4.在一定条件下(不需添加另外的反应物),经不同的化学反应,可实现如图的各种变化.其中A为酸式盐;B为无色无味气体,反应①、②属于非氧化还原反应.正盐A分解得到三种气体.X、F和Y为单质,其余为化合物.G为正盐,在高科技领域中常用液态F制造低温环境.Y常用来制取漂白粉.
请填空:
(1)写出下列物质的化学式:A(NH4)2CO3FN2.
(2)反应⑤的阴极产物为H2和NaOH.
(3)写出实际工业生产中X+F→D的反应条件5000C,20MPa-50MPa,铁触媒.
(4)当B过量时,写出B与W反应的离子方程式CO2+OH-=HCO3-.
(5)当D过量时,写出D与Y的反应的化学方程式8NH3+3Cl2=N2+6NH4Cl.
分析 在高科技领域中常用液态F制造低温环境,应为N2,Y常用来制取漂白粉,为Cl2,由转化关系可知D为NH3,X为H2,电解Z的溶液得到W、氢气与氯气,应是电解NaCl溶液,可推知W为NaOH,A为正盐,加热分解得到D(氨气)、C及无色无味气体B,且B与W反应得到G为正盐,G和无色气体M在溶液中可反应生成B,可推知B为CO2,A为(NH4)2CO3,C为H2O,G为Na2CO3,以此解答该题.
解答 解:在高科技领域中常用液态F制造低温环境,应为N2,Y常用来制取漂白粉,为Cl2,由转化关系可知D为NH3,X为H2,电解Z的溶液得到W、氢气与氯气,应是电解NaCl溶液,可推知W为NaOH,A为酸式盐,加热分解得到D(氨气)、C及无色无味气体B,且B与W反应得到G为正盐,G和无色气体M在溶液中可反应生成B,可推知B为CO2,A为NH4HCO3,C为H2O,G为Na2CO3,
(1)由以上分析可知A为(NH4)2CO3,F为N2,故答案为:(NH4)2CO3;N2;
(2)电解饱和食盐水,阴极发生还原反应生成氢气和氢氧化钠,故答案为:H2和NaOH;
(3)H2和NaOH为工业合成氨,反应条件下为5000C,20MPa-50MPa,铁触媒,故答案为:5000C,20MPa-50MPa,铁触媒;
(4)二氧化碳过量时,与氢氧化钠反应生成碳酸氢钠,离子方程式为CO2+OH-=HCO3-,故答案为:CO2+OH-=HCO3-;
(5)氨气和氯气发生氧化还原反应,氨气过量时生成氯化铵和氮气,方程式为8NH3+3Cl2=N2+6NH4Cl,故答案为:8NH3+3Cl2=N2+6NH4Cl.
点评 本题考查无机物推断,D的性质、M的颜色及F是空气的主要成份是推断突破口,需要学生熟练掌握元素化合物知识,难度不大.

 53随堂测系列答案
53随堂测系列答案| A. | 热还原法、热分解法、电解法 | B. | 电解法、热还原法、热分解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |
| A. | SO2→SO3→H2SO4 | B. | Al2O3→Al(OH)3→NaAlO2 | ||
| C. | FeCl2→Fe(OH)2→Fe(OH)3 | D. | CH2=CH2→CH3CH2OH→CH3CHO |
| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O═Cl-+SO42-+H+ |
| A. | Cl2 +H2O═HClO+HCl | B. | Na2O+H2O═2NaOH | ||
| C. | 2Na2O2 +2H2O═4NaOH+O2↑ | D. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NaCl+NH3 ↑+H2O |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量g | 0.255 | 0.385 | 0.459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
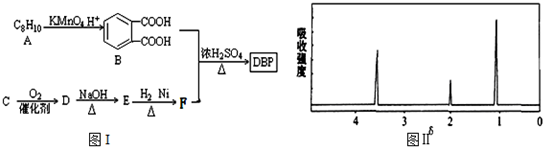
 $\stackrel{KMnO_{4}.H+}{→}$
$\stackrel{KMnO_{4}.H+}{→}$
 +H2O(-R1、R2表示氢原子或烃基)
+H2O(-R1、R2表示氢原子或烃基) ,反应类型为取代反应
,反应类型为取代反应 、
、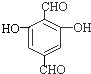 等.
等.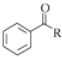 $→_{(S)-CBS}^{邻苯二酚硼烷}$
$→_{(S)-CBS}^{邻苯二酚硼烷}$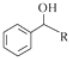 .根据已有知识并结合相关信息,写出以
.根据已有知识并结合相关信息,写出以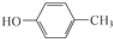 和CH3COOH为原料制备
和CH3COOH为原料制备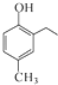 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.