题目内容
14.氯元素在人们的工农业生产和日常生活中具有广泛的应用,回答下列问题:(1)自然界中,氯元素有两种稳定的核素35Cl、37Cl,这两种核素原子中中子数之比为9:10,质量数之比为35:37;
(2)X、Y、Z与Cl元素的位置关系如图所示,其中X元素的某种单质也常常作为消毒剂,且消毒原理与次氯酸钠的消毒原理相近,Y元素是核聚变的重要原料,起消毒作用的X单质为O3(写化学式),作为核聚变的Y元素的元素符号是He,元素X与元素Z的非金属性大小关系是O>P(填元素符号);
(3)下列说法正确的是D
A、次氯酸钠溶液显碱性,故次氯酸钠在碱性条件下消毒效果最好
B、次氯酸钠消毒效果比高氯酸强,故次氯酸酸性比高氯酸强

C、高氯酸的酸性比硫酸强,但比高溴酸弱
D、氟尽管与氯同主族,但没有高氟酸.
分析 (1)中子数=质量数-质子数,核素左上角的为质量数,据此解答即可;
(2)依据X、Y、Z与Cl元素的位置关系如图,结合Y元素是核聚变的重要原料,得知Y为氦、X为氧、Z为磷,据此解答即可;
(3)A、起杀菌消毒作用的是HClO;
B、元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,与杀菌消毒无关;
C、元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强;
D、F无正化合价,据此判断即可.
解答 解:(1)Cl的原子序数为17,原子序数=质子数,中子数=质量数-质子数,35Cl的中子数=35-17=18,37Cl的中子数=37-17=20,故两者之比为18:20=9:10,质量数之比为35:37,故答案为:9:10;35:37;
(2)依据X、Y、Z与Cl元素的位置关系如图,结合Y元素是核聚变的重要原料,得知Y为氦、X为氧、Z为磷,臭氧具有杀菌消毒的作用,化学式为:O3,氦的元素符号为He,由于非金属性O>N>P,故O>P,故答案为:O3;He;O>P;
(3)A、起杀菌消毒作用的是HClO,故在酸性条件下,次氯酸钠的杀菌消毒效果好,故A错误;
B、元素的最高价氧化物对应的水化物的酸性比低价强,故B错误;
C、由于非金属性Cl>Br,故高氯酸的酸性强于高溴酸,故C错误;
D、F无正化合价,故无高氟酸,故D正确,故选D.
点评 本题主要考查的是质子数、中子数与质量数的关系,常见元素化合物的知识,难度不大.

练习册系列答案
相关题目
4.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A. | FeCl3溶液可用于刻制印刷铜电路板 | |
| B. | Na2O2常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 二氧化硅可做半导体材料 |
5. 冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处
冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处 所代表的微粒为( )
所代表的微粒为( )
 冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处
冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处 所代表的微粒为( )
所代表的微粒为( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF${\;}_{6}^{2-}$ |
2.下列各组离子,一定能在指定环境中大量共存的是( )
| A. | 在含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、Al3+、SO32- | |
| D. | 在由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Ba2+、Cl?、Br? |
9.下列化学反应中既有离子键、极性键、非极性键断裂又有离子键、极性键、非极性键形成的是( )
| A. | Cl2 +H2O═HClO+HCl | B. | Na2O+H2O═2NaOH | ||
| C. | 2Na2O2 +2H2O═4NaOH+O2↑ | D. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NaCl+NH3 ↑+H2O |
6.将下列各种液体(乙烯分子中含有一个碳碳双键)分别与溴水混合并震荡,不发生化学反应,静止后混合液分成两层,溴水层几乎无色的是( )
| A. | 氯水 | B. | 乙烯 | C. | 苯 | D. | 碘化钾溶液 |
3.当光束通过下列分散系时,不能产生丁达尔效应的是( )
| A. | 氢氧化铁胶体 | B. | 雾 | C. | 稀豆浆 | D. | 硫酸铜溶液 |
10.下列有关化学用语的表示正确的是( )
| A. | CSO的电子式: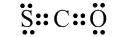 | B. | 二氧化碳的结构式:O-C-O | ||
| C. | 中子数为45的溴原子:3545Br | D. | Cl-离子的结构示意图 |