题目内容
5.下列实验方法或试剂保存方法正确的是( )| A. | 碘中混有沙子,不可以用升华方法提纯 | |
| B. | 金属钠通常保存在煤油里,不能保存在四氯化碳中 | |
| C. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒回试剂瓶中 | |
| D. | 把NaOH固体直接放入容量瓶中,加水到刻度线就配成一定物质的量浓度的NaOH溶液 |
分析 A.考虑碘的特性,碘易升华;
B.金属钠易与空气中氧气和水反应;
C.考虑试剂的取用原则;
D.考虑容量瓶的使用注意事项,容量瓶不能用来溶解或稀释溶液.
解答 解:A.碘易升华,故碘中混有沙子,可用升华方法提纯,故A错误;
B.金属钠易与空气中氧气和水反应,保存在煤油中隔绝空气,由于钠的密度小于四氯化碳,故不能保存在四氯化碳中,故B正确;
C.取用过的试剂一般不能放回原瓶,故C错误;
D.容量瓶不能用来溶解或稀释溶液,只能在烧杯中溶解或稀释溶液,待冷却后再转移到容量瓶中,故D错误.
故选B.
点评 本题考查了实验基本操作,特别要注意不能在容量瓶中溶解或稀释溶质,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
9.下列化学反应中既有离子键、极性键、非极性键断裂又有离子键、极性键、非极性键形成的是( )
| A. | Cl2 +H2O═HClO+HCl | B. | Na2O+H2O═2NaOH | ||
| C. | 2Na2O2 +2H2O═4NaOH+O2↑ | D. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NaCl+NH3 ↑+H2O |
10.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、Mg2+、OH-、Cl- | B. | H+、Na+、SO42-、CO32- | ||
| C. | K+、Ag+、Cl-、NO3- | D. | Ca2+、K+、Cl-、NO3- |
7.可能造成光化学烟雾污染的气体是( )
| A. | SO2 | B. | NO2 | C. | CO2 | D. | CO |
10.下列有关化学用语的表示正确的是( )
| A. | CSO的电子式: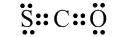 | B. | 二氧化碳的结构式:O-C-O | ||
| C. | 中子数为45的溴原子:3545Br | D. | Cl-离子的结构示意图 |
17.下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是Ar,最活泼的金属元素是K,最活泼的非金属元素是F.
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++ →
→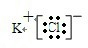 .
.
(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++
 →
→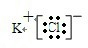 .
.(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |
15.如图所示装置能够组成原电池,并且能产生明显电流的是( )
| A. | 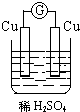 | B. | 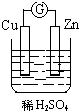 | C. | 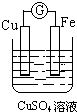 | D. | 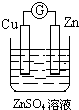 |