题目内容
19.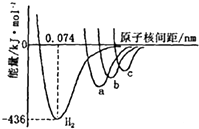 如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.
如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.
分析 图是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示Cl2的曲线的是a,因为Cl、Br、I三种原子中,Cl元素的原子半径最小,原子间形成分子时键长最短.
解答 解:图是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示Cl2的曲线的是a,因为Cl、Br、I三种原子中,Cl元素的原子半径最小,原子间形成分子时键长最短.
故答案为:a;Cl、Br、I三种原子中Cl原子半径最小,原子间形成分子时键长最短.
点评 本题综合考查原子结构与性质知识,为高考常见题型,注意把握原子结构特点,明确原子的结构特点为解答该题的关键,难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
9.下列关于钠及其化合物的叙述正确的是( )
| A. | Na和Na+的化学性质相似 | |
| B. | 钠在空气中燃烧生成氧化钠 | |
| C. | 钠可与硫酸铜溶液反应得到铜 | |
| D. | 实验室通常把钠保存在石蜡油或煤油中 |
10.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1mol羟基(-OH)中含电子数为10NA | |
| D. | 4.6g 金属钠与足量乙醇反应放出2.24L氢气 |
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| B. | 60gSiO2中含有NA个SiO2分子 | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA | |
| D. | 1molFe与1mol氯气反应转移3NA个电子 |
4.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A. | FeCl3溶液可用于刻制印刷铜电路板 | |
| B. | Na2O2常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 二氧化硅可做半导体材料 |
11.下列有关离子(或物质)的检验及结论,正确的是( )
| A. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体 | |
| B. | 焰色反应实验时,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 欲证明某溶液中含有Fe3+,滴加KSCN溶液,可观察到溶液会变为血红色 | |
| D. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO${\;}_{4}^{2-}$ |
8.下列化学变化属于加成反应的是( )
| A. | 在浓硫酸的作用下,乙醇和乙酸共热的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在光照条件下甲烷与氯气的反应 | |
| D. | 在浓硫酸的作用下,苯在55℃左右与浓硝酸的反应 |
9.下列化学反应中既有离子键、极性键、非极性键断裂又有离子键、极性键、非极性键形成的是( )
| A. | Cl2 +H2O═HClO+HCl | B. | Na2O+H2O═2NaOH | ||
| C. | 2Na2O2 +2H2O═4NaOH+O2↑ | D. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NaCl+NH3 ↑+H2O |
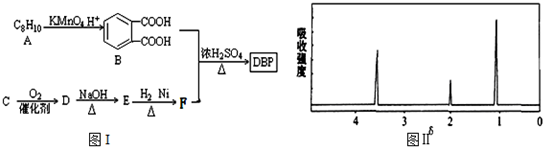
 $\stackrel{KMnO_{4}.H+}{→}$
$\stackrel{KMnO_{4}.H+}{→}$
 +H2O(-R1、R2表示氢原子或烃基)
+H2O(-R1、R2表示氢原子或烃基) ,反应类型为取代反应
,反应类型为取代反应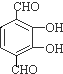 、
、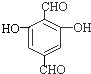 等.
等.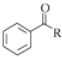 $→_{(S)-CBS}^{邻苯二酚硼烷}$
$→_{(S)-CBS}^{邻苯二酚硼烷}$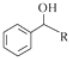 .根据已有知识并结合相关信息,写出以
.根据已有知识并结合相关信息,写出以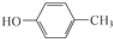 和CH3COOH为原料制备
和CH3COOH为原料制备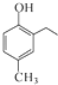 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.