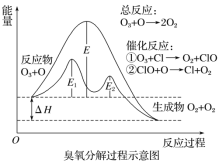
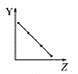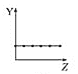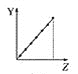题目内容
【题目】乙醛是一种重要的烃类衍生物,广泛应用于纺织、医药、化纤、染料和食品工业。
(一)以乙烯和氧气(或空气)为原料,在由PdCl2、CuCl2、盐酸组成的催化剂水溶液中,进行液相氧化生产乙醛,工业上一般控制反应温度在120~130℃,压强在300~350KPa。又称Wacker法。其反应式为:
主反应:CH2═CH2(g) +![]() O2(g)
O2(g) ![]() CH3CHO(g) ΔH=-243.2 kJ·mol-1
CH3CHO(g) ΔH=-243.2 kJ·mol-1
副反应:![]() CH2═CH2(g) +
CH2═CH2(g) + ![]() O2(g)
O2(g) ![]() CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1
CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1
(1)已知:水的汽化热是44.0 kJ·mol-1,请计算乙烯的燃烧热:ΔH =__________ kJ·mol-1
汽化热:在标准大气压(101KPa)下,使1mol物质在一定温度下蒸发所需要的热量。
(2)Wacker法乙烯氧化制乙醛过程,按照以下机理进行:
①乙烯羰基化反应:_____________________________
②金属钯的再氧化反应:Pd + 2CuCl2 = PdCl2 + 2CuCl
③氯化亚铜的氧化反应:2CuCl + ![]() O2 + 2HCl = 2CuCl2 + H2O
O2 + 2HCl = 2CuCl2 + H2O
请写出①的反应方程式__________________________。
(3)下列有关说法正确的是_______________
A.Wacker法制乙醛反应中,氯化钯是反应催化剂,氯化铜的作用是使催化剂再生,没有氯化铜的存在,就不能完成此催化过程。
B.工业上采用的原料气中乙烯大量过量,并有大量未反应的乙烯气要循环使用,这样可提高乙烯利用率,同时原料气中加入CO2有利于提高乙醛选择性。
C.原料气中乙烯大量过量的原因可能是为了让乙烯的体积分数处在爆炸极限范围之外,以避免危险的发生。
D.乙烯氧化生成乙醛的反应是在气-液相中进行的,加压和升温都有利于提高乙烯和氧在液体中的溶解度,加快反应速率。
(4)控制反应条件在120~130℃和300~350KPa,原料气的体积比是V(C2H4):V(O2):V(CO2):V(N2) = 15:10.5:9.5:65,以一定流速通入催化剂水溶液中,一段时间后反应达平衡,测得乙烯的体积分数是0.1,氧气的体积分数是0.05,如果充入100mol原料气,请计算反应达平衡时,n(CH3CHO) =
___________ mol。(不考虑HCl的挥发)
(二)实际工业生产要求有较高产量,速率不能太低,转化率尽可能大,所以应尽量使平衡正向移动。
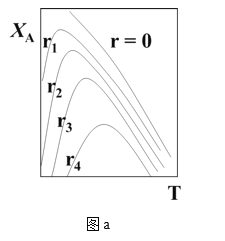
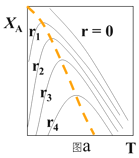
(1)可逆反应:aA+bB![]() rR +s S ,对反应物A,净反应速率为rA = r正(XA) – r逆(XA),XA为反应物A的转化率,图a表示反应物A的转化率和A的净反应速率与温度(T)的关系图。图a分析可知,在相同温度下,净反应速率为________时,XA最大(从“r=0、r1、r2、r3、r4”选填);由图a判断该反应是__________反应(填“吸热”或“放热”),并简述原因__________。
rR +s S ,对反应物A,净反应速率为rA = r正(XA) – r逆(XA),XA为反应物A的转化率,图a表示反应物A的转化率和A的净反应速率与温度(T)的关系图。图a分析可知,在相同温度下,净反应速率为________时,XA最大(从“r=0、r1、r2、r3、r4”选填);由图a判断该反应是__________反应(填“吸热”或“放热”),并简述原因__________。
(2)请在图a中绘制:在不同r下,符合工业生产要求的最佳温度__________。
【答案】-1499 CH2═CH2(g) + PdCl2 + H2O = CH3CHO + Pd + 2HCl ABC 4 r=0 放热 由图分析可知,反应达平衡时(r=0),随温度升高,XA降低,故该反应为放热反应 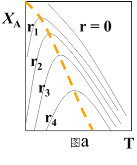
【解析】
利用已知热化学反应计算待求反应的H时,首先根据待求反应的反应物与生成物,选择相关的热化学反应,然后调整化学计量数进行相加减;在书写乙烯羰基化反应方程式时,需要考虑催化剂参与反应,所以方程式中应出现催化剂及中间产物;在判断说法的正误时,应从工业生产的实际出发,借助化学反应方程式进行判断;在计算乙醛的产量时,首先应分析发生的反应,然后建立三段式,利用已知数据建立关系式;在对坐标图象进行分析时,首先要弄清横坐标与纵坐标表示的意义,其次分析曲线的走势,从而确定曲线中特殊点产生的原因。
(一) (1)![]() CH2═CH2(g) +
CH2═CH2(g) +![]() O2(g)
O2(g) ![]() CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1 ①
CO2(g)+H2O(g) ΔH=-705.5kJ·mol-1 ①
H2O(g) ![]() H2O(l) ΔH=-44.0kJ·mol-1 ②
H2O(l) ΔH=-44.0kJ·mol-1 ②
利用盖斯定律,将①×2+②×2可得乙烯的燃烧热:ΔH =[(-705.5)×2+(-44.0)×2] kJ·mol-1=-1499 kJ·mol-1。答案为:-1499;
(2)乙烯羰基化是指乙烯在PdCl2的氧化下生成CH3CHO、Pd 等,则①的反应方程式为:CH2═CH2(g) + PdCl2 + H2O = CH3CHO + Pd + 2HCl。答案为:CH2═CH2(g) + PdCl2 + H2O = CH3CHO + Pd + 2HCl;
(3)A.Wacker法制乙醛反应中,氯化钯是反应的催化剂,参与反应(将乙烯氧化为乙醛)后被还原为Pd,CuCl2将其氧化为PdCl2,又可表现出催化能力,从而完成催化过程,A正确;
B.工业上采用的原料气中乙烯大量过量,可促进平衡正向移动,提高乙醛的产量,虽然乙烯的转化率降低,但由于原料气的循环使用,最终可提高乙烯的利用率;原料气中加入CO2,可降低乙烯氧化生成CO2的转化率,有利于提高乙醛的选择性,B正确;
C.乙烯与O2混合达到一定体积分数范围时会发生爆炸,所以原料气中乙烯大量过量的原因可能是为了让乙烯的体积分数处在爆炸极限范围之外,C正确;
D.乙烯氧化生成乙醛的反应是在气-液相中进行的,加压有利于提高乙烯和氧在液体中的溶解度,加快反应速率,但升温对乙烯和氧在液体中的溶解不利,D不正确;
故选ABC。答案为:ABC;
(4)原料气的体积比是V(C2H4):V(O2):V(CO2):V(N2) = 15:10.5:9.5:65,充入100mol原料气,则n(C2H4) =100mol×15%=15mol,n(O2) =100mol×10.5%=10.5mol。
设生成CH3CHO的CH2=CH2物质的量为x,燃烧生成CO2的CH2=CH2物质的量为y,则可建立下列三段式:
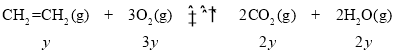
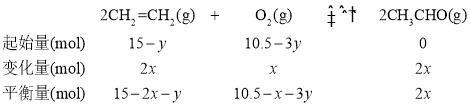
则![]() ①
①
![]() ②
②
解①、②方程,可求出x=2mol,所以反应达平衡时,n(CH3CHO) =4 mol。答案为:4;
(二)(1)图a分析可知,在相同温度下,转化率最大的点,其净反应速率为0,所以净反应速率为r=0时,XA最大;由图a可知,当转化率达到最高点后,升高温度,反应物的转化率降低,则平衡逆向移动,所以该反应是放热反应,原因是:由图分析可知,反应达平衡时(r=0),随温度升高,XA降低,故该反应为放热反应。答案为:r=0;放热;由图分析可知,反应达平衡时(r=0),随温度升高,XA降低,故该反应为放热反应;
(2)在不同r下,符合工业生产要求的最佳温度,是r=0的各个点的连线,图象为:
 。答为:
。答为: 。
。