题目内容
【题目】工业上以浓缩海水(含较高浓度的Br-)为原料提取溴的部分流程如下:
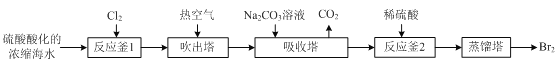
已知:3Br2+3CO32- =5Br- +BrO3- +3CO2↑。
图甲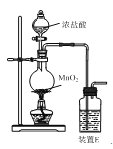 图乙
图乙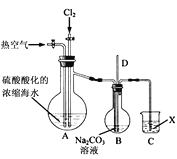
(1)反应用的Cl2可由图甲所示装置制取,制取Cl2的化学方程式为____。为除去Cl2中挥发出的HCl,装置E中所盛溶液是____。
(2)实验室用图乙所示装置模拟流程中的部分过程。
①通入Cl2时发生反应的离子方程式为____。
②通入热空气的作用是____。
③烧杯C中所盛溶液是____。
④烧瓶B中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,可以观察到的现象是____。
(3)“反应釜2”中所发生反应的离子方程式为____。
(4)蒸馏后,蒸馏塔溶液中仍溶有少量Br2,可以向其中加入少量____萃取其中的Br2。
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 饱和食盐水 Cl2+2Br-=Br2+2Cl- 将Br2从溶液中吹出 NaOH溶液 导管中液面上升 5Br-+BrO3-+6H+=3Br2+3H2O 四氯化碳(或苯)
MnCl2+Cl2↑+2H2O 饱和食盐水 Cl2+2Br-=Br2+2Cl- 将Br2从溶液中吹出 NaOH溶液 导管中液面上升 5Br-+BrO3-+6H+=3Br2+3H2O 四氯化碳(或苯)
【解析】
(1)二氧化锰与浓盐酸加热制取Cl2;氯化氢易溶于水,氯气在饱和食盐水中的溶解度小,则为除去Cl2中挥发出的HCl,装置E中所盛溶液是饱和食盐水;
(2)①通入Cl2时,可将Br-氧化为Br2;
②通入热空气能将溴吹入吸收塔,提高产量;
③烧杯C应为尾气处理装置,吸收未反应的Cl2、Br2等有毒气体,防止污染空气;
④烧瓶B中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,会将烧瓶中溶液压入玻璃管中,可以观察到的现象是导管中液面上升;
(3)Br2被NaCO3溶液吸收后,Br2反应生成Br-和BrO3-,加入稀硫酸后,会发生归中反应生成Br2;
(4)Br2易溶于四氯化碳(或苯),且四氯化碳(或苯)与水不互溶,据此解答。
(1)二氧化锰与浓盐酸加热制取Cl2,反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,为除去Cl2中挥发出的HCl,装置E中所盛溶液是饱和食盐水;
MnCl2+Cl2↑+2H2O,为除去Cl2中挥发出的HCl,装置E中所盛溶液是饱和食盐水;
故答案为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;饱和食盐水;
MnCl2+Cl2↑+2H2O;饱和食盐水;
(2)①通入Cl2时,可将Br-氧化为Br2,发生反应的离子方程式为Cl2+2Br-=Br2+2Cl-;
故答案为:Cl2+2Br-=Br2+2Cl-;
②通入热空气能将溴吹入吸收塔,提高产量,则通入热空气的作用是将Br2从溶液中吹出;
故答案为:将Br2从溶液中吹出;
③烧杯C应为尾气处理装置,吸收未反应的Cl2、Br2等有毒气体,防止污染空气,则所盛溶液应是NaOH溶液(或NaCO3溶液);
故答案为:NaOH溶液(或NaCO3溶液);
④烧瓶B中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,会将烧瓶中溶液压入玻璃管中,可以观察到的现象是导管中液面上升;
故答案为:导管中液面上升;
(3)Br2被NaCO3溶液吸收后,Br2反应生成Br-和BrO3-,加入稀硫酸后,会发生归中反应生成Br2,则“反应釜2”中所发生反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O;
故答案为:5Br- +BrO3- +6H+=3Br2 + 3H2O;
(4)Br2易溶于四氯化碳(或苯),且四氯化碳(或苯)与水不互溶,则蒸馏后,蒸馏塔溶液中仍溶有少量Br2,可以向其中加入少量四氯化碳(或苯)萃取其中的Br2,再进行蒸馏得到Br2;
故答案为:四氯化碳(或苯)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案