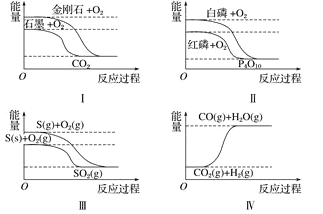
题目内容
【题目】下列关于阿伏伽德罗常数(NA)说法正确的是( )
A.lLpH=l的H3PO4溶液中,含有0.1NA个H+
B.在6.0gNaHSO4晶体中,所含离子数目为0.15NA
C.加热条件下,1molFe投入足量的浓硫酸中,生成NA个SO2分子
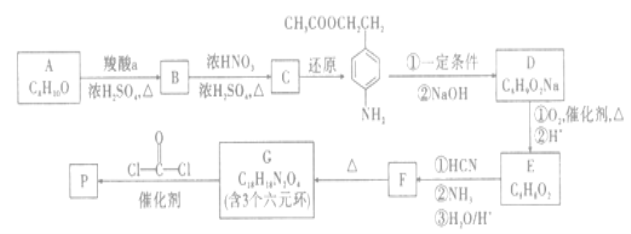
D.8.4g环戊烯醇![]() ,含有0.8NA个极性键
,含有0.8NA个极性键
【答案】A
【解析】
A. pH=l,c(H+)=0.1mol/L,N=NA·n=NA·c·V=0.1mol/L×1L×NA=0.1NA,A正确;
B.n(NaHSO4)=m/M=6.0g/120g·mol-1=0.05mol,NaHSO4晶体中含Na+、HSO4-,含离子数目为0.1NA,B错误;
C.加热条件下,由于浓硫酸具有强氧化性,1molFe被氧化成Fe3+失去3mol电子,根据电子得失守恒,S得到3mol电子,则生成SO21.5mol,数目为1.5NA个SO2分子,C错误;
D. 环戊烯醇的物质的量为8.4g/84g·mol-1=0.1mol,每分子环戊烯醇中含9个极性键,则共含有0.9NA个极性键,D错误;
答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目