题目内容
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
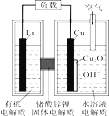
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
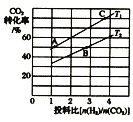
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
【答案】Fe3O4 2mol -130.8 b 0.18mol·L-1·min-1 KA=KC>KB > 1.25×10-3
【解析】
(1)①由示意图可以知道,重整系统中CO2和FeO反应生成FexOy和C,根据原子守恒确定FexOy的化学式;
②热分解系统中是FexOy分解为FeO与氧气,根据Fe元素化合价变价计算转移电子;
(2)已知:Ⅰ.CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,
Ⅱ.CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,
根据盖斯定律,Ⅰ×2-Ⅱ可得:2CO2(g)+ 6H2(g)![]() CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2;
CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2;
①a.逆反应速率先增大后减小,可能是增大生成物浓度;
b.H2的转化率增大,平衡一定正向移动;
c.反应物的体积百分含量减小,可能是增大生成物浓度等;
d.容器中的nCO2/nH2值变小,可能是减小二氧化碳的物质的量;
②T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,由图象可以知道,5 min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6 mol![]() 60%
60%![]() =1.8mol,根据平均反应速率v(CH3OCH3) =
=1.8mol,根据平均反应速率v(CH3OCH3) =![]() ;根据平衡常数仅与温度有关,温度不变,平衡常数不变,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大;
;根据平衡常数仅与温度有关,温度不变,平衡常数不变,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大;
(3)根据盐类水解规律,已知NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大;
反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
=![]() 。
。
(1)①由示意图可以知道,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO)/n(CO2)=6,根据Fe原子、O原子守恒可以知道x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;
因此,本题正确答案是:Fe3O4;
②热分解系统中是Fe3O4分解为FeO与氧气,分解1mol Fe3O4转移电子的物质的量为1mol![]() 3
3![]() (
(![]() -2)=2mol,
-2)=2mol,
因此,本题正确答案是:2mol;
(2)已知:Ⅰ.CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,
Ⅱ.CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,
根据盖斯定律,Ⅰ×2-Ⅱ可得:2CO2(g)+ 6H2(g)![]() CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2=2
CH3OCH3 (g)+3H2O(g),则△H3=2△H1-△H2=2![]() (-53.7kJ/mol)- 23.4kJ/mol =-130.8 kJ/mol;
(-53.7kJ/mol)- 23.4kJ/mol =-130.8 kJ/mol;
因此,本题正确答案是:-130.8;
①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故a错误;
b.H2的转化率增大,平衡一定正向移动,故b正确;
c.反应物的体积百分含量减小,可能是增大生成物浓度等,平衡逆向移动,故c错误;
d.容器中的nCO2/nH2值变小,可能是减小二氧化碳的物质的量,平衡逆向移动,故d错误,
故选:b;
②T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,由图象可以知道,5 min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6 mol![]() 60%
60%![]() =1.8mol,
=1.8mol,
所以平均反应速率v(CH3OCH3) =![]() =0.18mol·L-1·min-1;
=0.18mol·L-1·min-1;
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大,则KA=KC>KB;
因此,本题正确答案是:0.18mol·L-1·min-1;KA=KC>KB;
(3)根据盐类水解规律,已知NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,所以c(NH4+) 大于c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
=![]() =
=![]() =1.25
=1.25![]() 10-3;
10-3;
故答案为:>;1.25×10-3;

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数