题目内容
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显__________性,用离子方程式表示原因 , 其溶液中离子浓度大小顺序为_________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O![]() H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。
H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀 释后两种溶液的pH仍相等,则m__________n(填“<”、“>”或“=”)。
(5)①NaCl、②NaOH、③HCl、⑤CH3COONa、⑥CH3COOH,这5种溶液的物质的量浓度相同,则这5种溶液按 pH由大到小的顺序为:______________(填序号)
【答案】
(1)酸 NH4++H2O![]() NH3·H2O +H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-)
NH3·H2O +H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(2)10-3;10-11;(3)D;(4)m<n;
(5)②>⑤>①>⑥>③
【解析】
试题分析:(1)氯化铵为强酸弱碱盐,水解呈酸性,铵根离子水解的离子方程式为NH4++H2O![]() H++NH3H2O,铵根离子水解,则(Cl-)>c(NH4+),所以溶液中离子浓度关系为:(Cl-)>c(NH4+)>c(H+)>c(OH-);故答案为:酸;NH4++H2O
H++NH3H2O,铵根离子水解,则(Cl-)>c(NH4+),所以溶液中离子浓度关系为:(Cl-)>c(NH4+)>c(H+)>c(OH-);故答案为:酸;NH4++H2O![]() H++NH3H2O;(Cl-)>c(NH4+)>c(H+)>c(OH-);
H++NH3H2O;(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(OH-)=10-3mol/L,c(H+)=10-11mol/L,CH3COONa 中氢离子和氢氧根离子都是水电离的,则水电离出来的c(OH-)为10-3mol/L;在pH=3的CH3COOH溶液中,c(OH-)=10-11mol/L,酸中的氢氧根离子由水电离,则水电离出来的c(OH-)=c(H+)为10-11mol/L,故答案为:10-3mol/L;10-11mol/L;
(3)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;B.向水中加Na2CO3固体,水解呈碱性,故B错误;C.加热至100℃,促进水的电离,溶液呈中性,故C错误;D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;故答案为:D;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,故答案为:<;
(5)①NaCl ②NaOH ③HCl ④NH4Cl ⑤CH3COONa ⑥CH3COOH ⑦NH3H2O,显示碱性的为:②NaOH、⑤CH3COONa,⑦NH3H2O,氢氧化钠为强碱,NH3H2O为弱碱,CH3COONa为盐,所以pH②>⑦>⑤;显示中性的为①NaCl,pH=7;显示酸性的为:③HCl ④NH4Cl⑥CH3COOH,浓度相同时,盐酸为强酸,氢离子浓度最大,醋酸为一元弱酸,氢离子浓度小于盐酸,而氯化铵为强酸弱碱盐,氢离子浓度较小,所以三种酸性溶液的pH大小关系为:④>⑥>③,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑦>⑤>①>④>⑥>③,故答案为:②>⑦>⑤>①>④>⑥>③。

 一本好题口算题卡系列答案
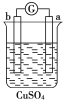
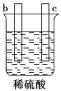
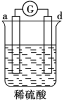
一本好题口算题卡系列答案【题目】有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
实验装置 |
|
|
|
|
实验现象 | a极质量减小, b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c