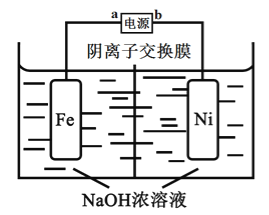
题目内容
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
【答案】C
【解析】
试题由表可知平衡时,X的浓度变化量是0.05mol/L,Z的变化量是0.15mol/L,Z的变化量是0.1mol/L,反应的化学计量系数之比等于浓度变化量之比,参与反应的n(X) : n(Y) : n(Z) = 1:3:2,所以反应可以表示为X+3Y![]() 2Z。C项,该反应正反应方向是体积减小的反应,增大压强平衡右移,但是平衡常数不变,故C项错误;A项,平衡时X的转化率为0.05/0.1*100%=50%,故A项正确;B项,平衡常数K=(0.12)/(0.053*0.05)=1600,故B项正确;D项,平衡常数只与反应本身和温度有关,改变温度可以改变此反应的平衡常数,故D项正确。综上所述,本题正确答案为C。
2Z。C项,该反应正反应方向是体积减小的反应,增大压强平衡右移,但是平衡常数不变,故C项错误;A项,平衡时X的转化率为0.05/0.1*100%=50%,故A项正确;B项,平衡常数K=(0.12)/(0.053*0.05)=1600,故B项正确;D项,平衡常数只与反应本身和温度有关,改变温度可以改变此反应的平衡常数,故D项正确。综上所述,本题正确答案为C。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】氯碱工业是最基本的化学工业之一,其产品用途广泛。
(1)写出氯碱工业电解食盐水的离子方程式____________。
(2)①图1是氯碱工业中阳离子交换膜电解槽示意图(“阳离子交换膜”特性是只允许阳离子通过而阻止阴离子和气体通过)。
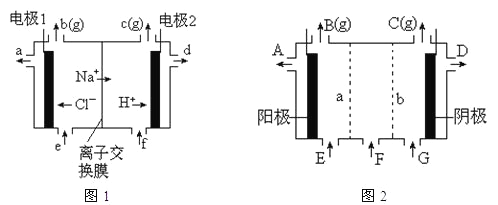
图1中电极1应连接电源的__极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是_____。
②图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。其中a、b处均设有离子交换膜,则a处为__(填“阳”、“阴”)离子交换膜。阳极的电极反应式是___。从D口流出的物质为____。
(3)某同学采用如下装置对氯碱工业中电解食盐水的条件进行探究,记录如下:
装置 | 编号 | 条件控制 | 测定结果 | ||||
电极材料 | 溶液浓度 | 温度/℃ | *电解电压/V | 气体V阴:V阳 | |||
阴极 | 阳极 | ||||||
| I | C | C | 1 mol/L | 25 | 8 | >1:1 |
II | 饱和 | 25 | 5 | ≈1:1 | |||
III | 饱和 | 50 | 4 | ≈1:1 | |||
IV | Fe | C | 饱和 | 50 | 3.5 | ≈1:1 | |
电解电压:开始发生电解反应时的电压
①对比实验I和Ⅱ阴、阳极气体体积比,推测实验I阳极可能有其它气体生成,其它气体的化学式为_____。
②资料显示:“较低的电解电压有利于节能降耗……”。结合上表中Ⅲ和Ⅳ的数据,解释Ⅳ更有利于节能降耗的原因_______________。
(4)资料显示“氯碱工业中采用金属阳极材料,可以降低电解电压,实现节能降耗”,该同学用50℃的饱和NaCl溶液进行实验验证,结果如下:
装置 | 编号 | 电极材料 | 电解 电压/V | 现象 | |
阴极 | 阳极 | ||||
| V | Fe | Fe | 1.5 | 阴极:产生无色气体 U形管底部:有白色沉淀生成 |
VI | Fe | Cu | 2 | 阴极:产生无色气体 阳极:有白色胶状沉淀生成且逐渐增多 U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色,最后变成砖红色 | |
实验V中,通过检验阴、阳极附近溶液所含离子,推断产生白色沉淀为Fe(OH)2 。该同学经查阅资料分析认为:“实验VI中白色沉淀是CuCl,淡黄色沉淀是CuOH。
i.阳极生成CuCl的电极反应式为_________。
ii.用化学用语和必要文字解释阴极区白色胶状沉淀转化为淡黄色的原因___________。
该同学通过以上探究认为,氯碱工业中不能采用Fe、Cu作阳极材料。
(5)综合以上探究,你对氯碱工业中电解食盐水条件控制的建议有 _____(至少写出两条)。