题目内容
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 单位体积内有效碰撞的次数增多
【答案】B
【解析】
用有效碰撞理论解释外因对化学反应速率的影响。
化学反应速率的定义v=![]() =
=![]() 表明,单位时间、单位体积内有效碰撞的次数(Δn)增加,化学反应速率才能增大。只有活化分子才可能发生有效碰撞。
表明,单位时间、单位体积内有效碰撞的次数(Δn)增加,化学反应速率才能增大。只有活化分子才可能发生有效碰撞。
A项:单位体积内活化分子数增加,才能加快反应速率。A项错误;
B项:增大反应物浓度,使单位体积内活化分子数增多,单位时间、单位体积内有效碰撞的次数增加,即化学反应速率增大。B项正确;
C项:增大反应物浓度,不能改变活化分子百分数。C项错误;
D项:不是单位时间内,反应速率不一定增大。D项错误。
本题选B。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】(1)了解用药常识,有利于自我保健。现有下列药物:
A.阿司匹林(乙酰水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是____________。(填字母)
②治疗胃酸过多,但患有严重的胃溃疡,应该选择___________。(填字母)
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是____________。(填字母)
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是___________。(填字母)
(2)防治环境污染,改善生态环境已成为全球的共识。
①今年入冬以来,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是_______(填字母)。
A.SO2 B.NO2 C.PM2.5
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________ (填字母)标志的垃圾筒内。

③工业废水需处理达标后才能排放。下列废水处理的方法合理的是____________。
A.用中和法除去废水中的酸
B.用混凝剂除去废水中的重金属离子
C.用氯气除去废水中的悬浮物
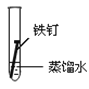
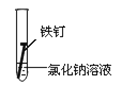
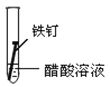
(3)全世界每年因钢铁锈蚀造成大量的损失。某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验。
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为______的试管中铁钉锈蚀速度最慢。
②下列防止钢铁锈蚀的措施不合理的是__________(填字母)。
A.在自行车的钢圈表面镀镍
B.在地下钢铁管道上连接铜块
C.改变金属内部结构制成不锈钢
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:铁锅的腐蚀主要是由__________________腐蚀造成的。