题目内容
8.写出下列离子方程式:(1)Na3PO4水解的离子方程式PO43-+H2O?OH-+HPO42-;HPO42-+H2O?OH-+H2PO4-;H2PO4-+H2O?
 OH-+H3PO4
OH-+H3PO4(2)H2 SO3电离方程式H2SO3?H++HSO3-;HSO3-?H++SO32-
(3)Na2S水解的离子方程式S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
(4)磷酸电离方程式H3PO4?H++H2PO4-、H2PO4-?H++HPO42-、HPO42-?H++PO43-
(5)醋酸铵电离方程式CH3COONH4
 CH3COO-+NH4+.
CH3COO-+NH4+.
分析 (1)磷酸根离子为多元弱酸根离子,分步水解,用可逆号;
(2)亚硫酸为多元弱酸,是弱电解质,分步电离,用可逆号;
(3)硫离子为多元弱酸根离子,分步水解,用可逆号;
(4)磷酸为多元弱酸,是弱电解质,分步电离,用可逆号;
(5)醋酸铵为强电解质,完全电离.
解答 解:(1)磷酸根离子水解的离子方程式为:PO43-+H2O?OH-+HPO42-;HPO42-+H2O?OH-+H2PO4-;H2PO4-+H2O?OH-+H3PO4;
故答案为:PO43-+H2O?OH-+HPO42-;HPO42-+H2O?OH-+H2PO4-;H2PO4-+H2O?OH-+H3PO4;
(2)亚硫酸为弱电解质,电离方程式为:H2SO3?H++HSO3-;HSO3-?H++SO32-;
故答案为:H2SO3?H++HSO3-;HSO3-?H++SO32-;
(3)硫离子水解的离子方程式为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(4)磷酸为多元弱酸,分步电离,电离方程式为:H3PO4  H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-;
H++PO43-;
故答案为:H3PO4  H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-  H++HPO42-、HPO42-
H++HPO42-、HPO42-  H++PO43-;
H++PO43-;
(5)醋酸铵为强电解质,完全电离,电离方程式为:CH3COONH4=CH3COO-+NH4+;
故答案为:CH3COONH4=CH3COO-+NH4+;
点评 本题考查了离子方程式的书写,侧重考查盐类的水解和弱电解质的电离,明确盐类水解的规律,电解质的强弱和电离方式是解题感觉,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
19.某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙.过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成.下列所得结论不正确的是( )
| A. | 铜与浓硫酸反应所得白色固体甲是CuSO4 | |
| B. | 加BaCl2溶液后所得白色沉淀是BaSO3 | |
| C. | 白色固体甲中夹杂的少量黑色物质乙中不可能含有CuO | |
| D. | 白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S |
16.下列关于各图象的解释或得出结论正确的是( )

| A. | 图1表示0.10mol•L-1NaOH溶液滴定20.00mL0.10mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图3所示可知:石墨比金刚石稳定 | |
| D. | 图4表示反应:2SO2+O2?2SO3,t1时刻只减小的SO3的浓度 |
3.下列说法正确的是( )
| A. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积,其比值一定为2:1 | |
| B. | 将NaOH溶液和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的二分之一 | |
| C. | 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍 | |
| D. | 制取TiO2可用TiCl4加大量水,同时加热:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl,所得的TiO2•H2O经焙烧得TiO2 |
13.配制100ml 0.1mol•L-1Na2CO3溶液,下列说法正确的是( )
| A. | 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取1.1 g无水碳酸钠时,砝码与碳酸钠放反,所配溶液浓度偏高 | |
| C. | 转移碳酸钠溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.2mol•L-1 |
20.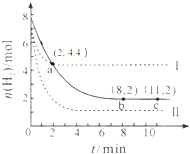 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 曲线Ⅰ对应的条件改变可能降低温度 | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 该温度下,此反应的化学平衡常数的数值为0.5 | |
| D. | 从反应开始至a 点,ν(CO2)=0.6 mol•L-1•min-1 |
17.下列说法正确的是( )
| A. | 同一周期中的第ⅡA族和第ⅢA族元素的原子序数差一定为1 | |
| B. | L层上的电子数为奇数的元素一定是主族元素 | |
| C. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| D. | 族序数等于周期序数的元素一定是金属元素 |
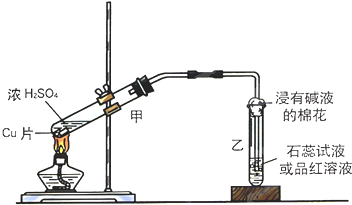 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.