题目内容
1.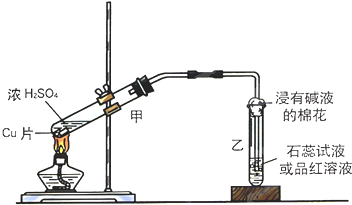 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成浸有品红溶液的棉花褪色或浸有石蕊试液的棉花变红.
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成甲装置中的溶液变为蓝色.
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式SO2+Na2CO3═Na2SO3+CO2.
分析 (1)二氧化硫为酸性氧化物,能够使石蕊试液变红,能够使品红溶液褪色;硫酸铜溶液为蓝色溶液;
(2)二氧化硫与碳酸钠溶液反应生成亚硫酸钠和二氧化碳,据此写出反应的化学方程式.
解答 解:(1)二氧化硫具有漂白性,能够使品红溶液褪色,若浸有品红溶液的棉花褪色或浸有石蕊试液的棉花变红,则证明反应中生成的二氧化硫;
硫酸铜溶液为蓝色溶液,则甲装置中溶液变成蓝色,则证明反应生成了硫酸铜,
故答案为:浸有品红溶液的棉花褪色或浸有石蕊试液的棉花变红;甲装置中的溶液变为蓝色;
(2)二氧化硫有毒,利用蘸有碳酸钠浓溶液的棉花放在试管口处,能吸收二氧化硫,防止二氧化硫污染空气,反应的化学方程式为:SO2+Na2CO3═Na2SO3+CO2,
故答案为:SO2+Na2CO3═Na2SO3+CO2.
点评 本题考查了浓硫酸的性质,题目难度中等,明确铜与浓硫酸的反应为解答关键,注意掌握浓硫酸的性质、二氧化硫的检验方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
3.据报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
| A. | O2(PtF6)晶体中含有离子键 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| D. | 反应中,每生成1mol O2(PtF6)转移1mol电子 |
10.下列说法正确的是( )
| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 体积、pH均相同的醋酸和盐酸完会溶解等量的镁粉(少量),后者用时少 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| D. | 常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
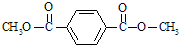 .
.
 .
. .
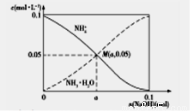
.
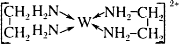
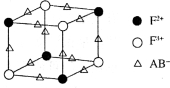

 OH-+H3PO4
OH-+H3PO4