题目内容
13.配制100ml 0.1mol•L-1Na2CO3溶液,下列说法正确的是( )| A. | 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取1.1 g无水碳酸钠时,砝码与碳酸钠放反,所配溶液浓度偏高 | |
| C. | 转移碳酸钠溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.2mol•L-1 |
分析 A.配制溶液时,固体的溶解要在烧杯中进行,不能用容量瓶溶解;
B.砝码与碳酸钠放反,质量偏小;
C.移液时用玻璃棒引流,防止液体溅出;
D.浓度与体积无关.
解答 解:A.配制溶液时,固体的溶解要在烧杯中进行,容量瓶是精密仪器,不能用容量瓶溶解,故A错误;
B.砝码与碳酸钠放反,质量偏小,浓度偏低,故B错误;
C.移液时用玻璃棒引流,防止液体溅出,否则导致浓度偏小,故C错误;
D.浓度与体积无关,0.1mol•L-1Na2CO3溶液中Na+浓度为0.2mol•L-1,故D正确.
故选D.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,注意掌握配制一定物质的量浓度的溶液方法,明确误差分析的方法与技巧.

练习册系列答案
相关题目
1.298.15K时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
2.X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是( )
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 |
20.短周期元素A、B、C、D在元素周期表中的相对位置如图所示,A和D的质子数之和为22.下列说法正确的是( )
| A | B | ||
| C | D |
| A. | A、C、D的最高价氧化物对应水化物的酸性强弱顺序:D>C>A | |
| B. | B和C形成的化合物具有两性 | |
| C. | C的阳离子与B的阴离子的电子层结构不同 | |
| D. | D元素的最简单氢化物的热稳定性大于B元素的最简单氢化物 |
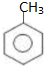
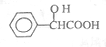 ,工业上扁桃酸可以由烃A经过以下步骤合成得到:
,工业上扁桃酸可以由烃A经过以下步骤合成得到: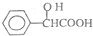
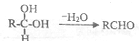
 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
.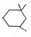 )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
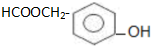 .
.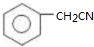 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸(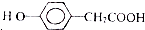 )的合理路线.
)的合理路线. OH-+H3PO4
OH-+H3PO4



 .
.