题目内容
19.某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙.过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成.下列所得结论不正确的是( )| A. | 铜与浓硫酸反应所得白色固体甲是CuSO4 | |
| B. | 加BaCl2溶液后所得白色沉淀是BaSO3 | |
| C. | 白色固体甲中夹杂的少量黑色物质乙中不可能含有CuO | |
| D. | 白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S |
分析 Cu与浓H2SO4的主反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,由于浓H2SO4过量且浓硫酸具有吸水性,故所得白色固体为CuSO4;由于浓硫酸过量,黑色固体不可能为CuO;至于黑色固体成分,从题意知,它溶于浓硝酸,溶液呈蓝色说明含Cu2+,加入BaCl2溶液产生了不溶于硝酸的沉淀BaSO4,原黑色沉淀中含S元素,含Cu、S两元素,可能为CuS也可能为Cu2S.
解答 解:A、因倒入盛有少量水的烧杯中,发现所得溶液为蓝色,说明白色固体是CuSO4,这个白色的CuSO4是由于浓硫酸具有吸水性使生成的CuSO4过饱和而析出,故A正确;
B、因倒入烧杯时含有少量硫酸,所以加BaCl2溶液后所得白色沉淀是BaSO4,酸性溶液中不可能生成BaSO3,故B错误;
C、将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,浓硫酸稀释成稀硫酸,使CuO溶解,故黑色物质中不可能有CuO,故C正确;
D、加硝酸后黑色物质溶解溶液呈蓝色,且加BaCl2溶液后有白色沉淀生成,所以黑色物质一定含有元素Cu和S,故D正确,
故选B.
点评 本题主要考查浓硫酸与铜反应物质的组成探究,题目难度中等,注意从浓硫酸的性质角度思考,根据反应实验现象进行分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.据报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
| A. | O2(PtF6)晶体中含有离子键 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,O2是氧化剂,PtF6是还原剂 | |
| D. | 反应中,每生成1mol O2(PtF6)转移1mol电子 |
10.下列说法正确的是( )
| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 体积、pH均相同的醋酸和盐酸完会溶解等量的镁粉(少量),后者用时少 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| D. | 常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
14.如图所示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )
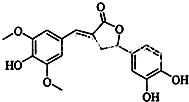

| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol 该化合物最多能与5mol NaOH反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2 |
11.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图,则下列说法中正确的是( )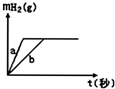

| A. | 曲线a为K,b为Na | B. | 投入的Na的质量大于K的质量 | ||
| C. | 投入的Na、K一定等质量 | D. | 稀盐酸的量一定是不足量的 |
9.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1 mol甲基的电子数目为10NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
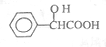 ,工业上扁桃酸可以由烃A经过以下步骤合成得到:
,工业上扁桃酸可以由烃A经过以下步骤合成得到: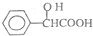
 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
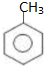
. )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
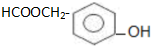 .
.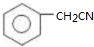 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸(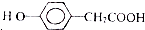 )的合理路线.
)的合理路线. OH-+H3PO4
OH-+H3PO4