题目内容
8.下列关于物质性质变化的比较中正确的( )①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③热稳定性:HCl>H2S>PH3
④还原性:F->Cl->Br-.
| A. | ①②④ | B. | ②③④ | C. | ①②③ | D. | ①②③④ |
分析 ①元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
②元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
③非金属性越强,气态氢化物越稳定;
④非金属性越强,对应离子的还原性越弱.
解答 解:①非金属性:Cl>Br>I,元素的非金属性减弱,对应的最高价氧化物的水化物的酸性减弱,则有HClO4>HBrO4>HIO4,故①正确;
②金属性:Ba>Ca>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性强弱:Ba(OH)2>Ca(OH)2>Mg(OH)2,故②正确;
③非金属性Cl>S>P,气态氢化物的稳定性为HCl>H2S>PH3,故③正确;
④非金属性F>Cl>Br,对应离子的还原性为F-<Cl-<Br-,故④错误;
故选C.
点评 本题考查元素周期律,熟悉元素在周期表中的位置及元素周期律是解答本题的关键,难度不大.

练习册系列答案
相关题目
18.下列各项中表达正确的是( )
| A. | F-的结构示意图: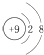 | B. | CH4分子的比例模型: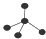 | ||
| C. | CCl4的电子式: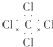 | D. | 乙烯的结构简式:CH2CH2 |
19.下列各物质属于芳香烃的是( )
| A. | 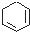 | B. |  | C. | 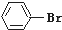 | D. | 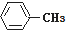 |
3.若要使0.5mol甲烷完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需要氯气的物质的量为( )
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
13.下列叙述中正确的是( )
| A. | 金属的熔点和沸点都很高 | |
| B. | H2O、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
20.下列化合物中既有离子键又有共价键的是( )
| A. | CaBr2 | B. | Na2O2 | C. | HBr | D. | N2 |
17.下列有关酸雨的说法正确的是( )
| A. | 酸雨就是指pH<7的雨水 | |
| B. | 工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因 | |
| C. | 酸雨是因为雨水中含有CO2 | |
| D. | 酸雨没有危害,所以不必担心,也不必想办法治理 |
18.正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | H、D、T互为同素异形体 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | NH4Cl的电子式: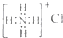 | |
| D. | S2-的结构示意图: |