题目内容
【题目】下列研究目的和示意图相符的是( )
选项 | A | B | C | D |
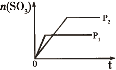
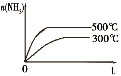
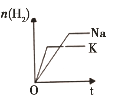
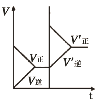
研究目的 | 密闭容器中,压强对反应:2SO2(g)+O2(g) | 固定容积的密闭容器中,温度对反应:N2(g)+3H2(g) | 等质量Na、K分别与足量水反应 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g) |
示意图 |
|
|
|
|
A.AB.BC.CD.D
【答案】C
【解析】
A.依据先拐先平压强大,P1>P2,三氧化硫含量随压强增大而增大,图象变化与三氧化硫含量随压强增大而增大不符合,故A错误;
B.依据先拐先平温度大,反应是放热反应,升温平衡逆向进行,氨气物质的量减小,图象与之不符合,故B错误;
C.等质量钾和钠,钾摩尔质量为39g·mol1,钠摩尔质量为23g·mol1,依据电子守恒可知与水反应,钾生成的氢气少,但钾活泼性大于钠,反应快先反应完,图象与之符合,故C正确;
D.增大二氧化碳浓度,逆反应速率瞬间增大,正反应速率瞬间不变,平衡逆向进行,图象与之不符合,故D错误。
综上所述,答案为C。

【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请按要求回答下列问题:
(1)元素①与⑨组成的化合物的电子式:_______;元素②的原子结构示意图_______。
(2)对比相同条件下元素⑥、⑦的单质分别与水反应的剧烈程度,可得到的结论:同一周期元素,随核电荷数的增加,_______;写出元素⑥的单质与水反应的化学方程式_______。
(3)能说明元素⑤的非金属性强于元素⑨的依据是_______。
(4)元素①与②所形成的最简单有机物的结构式是_______。元素①与②所形成的最简单烯烃为M,写出M与元素①的单质在一定条件下反应的化学方程式:_______,该反应类型为_______。
【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。