题目内容
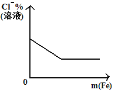
【题目】25℃时,向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示 ,下列叙述错误的是
,下列叙述错误的是

A.从M点到N点的过程中,c(H2C2O4)逐渐增大
B.直线n表示pH与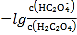 的关系
的关系
C.由N点可知Ka1 (H2C2O4)的数量级为10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
【答案】D
【解析】
A. 如图所示,从M点到N点的过程中,pH减小,氢离子浓度增大,c(H2C2O4)逐渐增大,故A正确;
B. pH增大, 增大,
增大, 减小,则直线n表示pH与
减小,则直线n表示pH与 的关系,故B正确;
的关系,故B正确;
C. 由N点可知Ka1 (H2C2O4)的数量级为10 -2
Ka1(H2C2O4)= ,在N点
,在N点 =-1,即
=-1,即 ,N点的pH=2.22,则c(H+)=102.22mol/L,所以Ka1(H2C2O4)=10×102.22=1.0×101.22,故C正确;
,N点的pH=2.22,则c(H+)=102.22mol/L,所以Ka1(H2C2O4)=10×102.22=1.0×101.22,故C正确;
D. M点:-lg =0,Ka2=
=0,Ka2= =10-3.18×10-1=10-4.18,pH=4.18时,c(HC2O4-)= c(C2O42-),但无法判断c(HC2O4-)= c(C2O42-) =c(Cl-),故D错误;
=10-3.18×10-1=10-4.18,pH=4.18时,c(HC2O4-)= c(C2O42-),但无法判断c(HC2O4-)= c(C2O42-) =c(Cl-),故D错误;
故选D。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
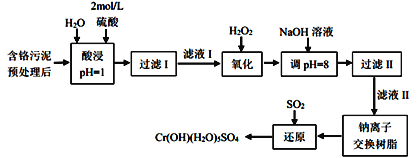
已知: ① 硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。
② Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
③ 常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4mol/L的浓硫酸配制500mL2mol/L的硫酸时除用量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有_________________________。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式__________。
(3)过滤II操作得到的滤渣主要为______(填化学式)。
(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_________________。
(5)上述流程中,每还原1molCrO42-时,需要消耗SO2 _______ mol。