题目内容
19.下表是某地区市场上销售的一种“加碘食盐”的包装袋上的部分文字说明.请根据下表回答下列问题.| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20mg/kg~40mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.胰岛素 B.甲状腺素
C.生长激素 D.雄性激素
②长期生活在缺碘山区,又得不到食盐的供应,易患C.
A.甲状腺亢进 B.贫血症
C.地方性甲状腺肿大 D.糖尿病
③食盐中加碘,这碘指的是元素(填“元素”、“原子”或“单质”).
④碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
分析 (1)碘与甲状腺素有关;
(2)缺碘易患地方性甲状腺肿;
(3)“含碘量”中的碘是指其中含有的碘元素的质量;
(4)化合物中元素的正负化合价的倒数和为0.
解答 解:(1)碘是合成甲状腺素的主要原料,故答案为:B;
(2)缺碘易患地方性甲状腺肿,故答案为:C;
(3)食盐中加碘,含碘量是指的元素,而不是单质或化合物,故答案为:元素;
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为0-(+1)-(-2)×3=+5,故答案为:+5.
点评 本题考查加碘食盐的成分和性能,为高频考点,把握习题中的信息及相关化学与生活的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
9.元素A的阳离子与元素B的阴离子具有相同的电子层结构.以下关于A.B元素性质的比较中,不正确的是( )
| A. | 原子半径:A<B | |
| B. | 原子序数:A<B | |
| C. | 元素所在的周期数:A>B | |
| D. | A的最高正价与B的最低负价的绝对值一定相等 |
7. 把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如图所示.下列因素中,可能影响该反应的反应速率的因素是( )
把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如图所示.下列因素中,可能影响该反应的反应速率的因素是( )
①盐酸的浓度 ②镁条的表面积③溶液的温度 ④Cl-的浓度.
 把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如图所示.下列因素中,可能影响该反应的反应速率的因素是( )
把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化如图所示.下列因素中,可能影响该反应的反应速率的因素是( )①盐酸的浓度 ②镁条的表面积③溶液的温度 ④Cl-的浓度.
| A. | ①④ | B. | ③④ | C. | ①②③ | D. | ②③ |
14.下列有关化学用语表示正确的是( )
| A. | Na2O2的电子式为 Na${\;}_{•}^{•}$$\stackrel{••}{O}$${\;}_{•}^{•}$${\;}_{•}^{•}$$\stackrel{••}{O}$${\;}_{•}^{•}$Na | |
| B. | NH4Br的电子式: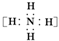 +Br- +Br- | |
| C. | 氢氧根离子的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | |
| D. | HClO的电子式:H${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
4.下列关于乙烯的说法不正确的是( )
| A. | 分子中含有碳碳双键 | B. | 可作水果催熟剂 | ||
| C. | 分子式为C2H6 | D. | 能使溴水褪色 |
11.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、Ag+、SO42-、Cl- | B. | Fe2+、NO3-、Ba2+、H+ | ||
| C. | K+、CO32-、Cl-、OH- | D. | Na+、Al3+、AlO2-、CO32- |
8.根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )
| A. | 固体氯化钠溶于水 | B. | 氯化铵受热分解生成氯化氢和氨气 | ||
| C. | 冰经加热变成水蒸气 | D. | 氯化氢溶于水 |
 ;
;