题目内容
10.A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子.则:(1)B、C、E分别与A形成的化合物中最稳定的是H2O(写化学式);沸点最高的是H2O B的原子结构示意图
 ;
;(2)C与D形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物;
(3)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为SO2+Cl2+2H2O═4H++SO42-+2Cl-.
(4)A与C形成的化合物中含非极性键的化合物的结构式为H-O-O-H.
(5)用电子式表示X的形成过程

(6)D与NaOH溶液反应的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
分析 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,所以X为NH3,再结合A的原子序数比B小可知:B为N元素、A为H元素;D的简单阳离子与X具有相同电子数,NH3含有10个电子,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最小的元素,则D为Al元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Al,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C最外层有6个电子,原子序数比Na小,则C为O元素,结合元素对应的单质、化合物的性质解答该题.
解答 解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性,所以X为NH3,再结合A的原子序数比B小可知:B为N元素、A为H元素;D的简单阳离子与X具有相同电子数,NH3含有10个电子,D的简单阳离子为10e-结构,且D是同周期中简单离子半径最小的元素,则D为Al元素;E元素的原子最外层比次外层少两个电子,E的原子序数大于Al,则E有3个电子层,最外层电子数为6,则E为S元素;F的原子序数比E大且为短周期主族元素,则F是Cl元素;C、F两种元素的原子最外层共有13个电子,C最外层有6个电子,原子序数比Na小,则C为O元素,
(1)A为H元素,B、C、E分别为N、O、S元素,非金属性越强,则氢化物越稳定,则稳定性最强的为:H2O;由于水分子之间存在氢键,则水的沸点最高;
B为N元素,原子核外电子数是7,有2个电子层,最外层有5个电子,原子结构示意图为 ,
,
故答案为:H2O;H2O; ;
;
(2)C、D分别为O、Al元素,C与D形成的化合物为氧化铝,其化学式为:Al2O3;氧化铝既能够与酸反应,也能够与强碱溶液反应,所以氧化铝属于两性氧化物,
故答案为:Al2O3;两性氧化物;
(3)F是Cl元素,其单质具有强氧化性,在反应中常作氧化剂;该单质的水溶液与E的低价氧化物二氧化硫发生氧化还原反应生成硫酸和氯化氢,反应的离子方程式为:SO2+Cl2+2H2O═4H++SO42-+2Cl-,
故答案为:氧化;SO2+Cl2+2H2O═4H++SO42-+2Cl-;
(4)A与C形成的化合物中含非极性键的化合物为双氧水,其结构式为H-O-O-H,故答案为:H-O-O-H;
(5)X为氨气,氨气为共价化合物,用电子式表示氨气的形成过程为: ,故答案为:
,故答案为: ;
;
(6)D为铝,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系的应用,题目难度中等,推断元素是解题关键,“X的水溶液呈碱性”是推断突破口,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

①
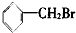 ②
②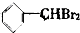 ③
③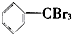 ④
④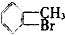 ⑤
⑤ ⑥
⑥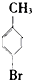 ⑦
⑦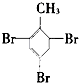
| A. | 仅①②③ | B. | 仅⑦ | C. | 仅④⑤⑥⑦ | D. | 全部 |
| A. | 含有离子键的晶体一定是离子晶体 | |
| B. | 离子晶体中一定不含共价键 | |
| C. | Na2O和SiO2的晶体中都不存在单个分子 | |
| D. | 干冰与氖晶体熔化时克服的微粒间的作用力的类型相同 |
| A. | 同质量的乙炔和苯完全燃烧生成二氧化碳的质量完全相等 | |
| B. | 都容易发生取代反应 | |
| C. | 苯只能在特殊条件下发生加成反应 | |
| D. | 苯不能被KmnO4所氧化 |
| A. | 半径:Al3+>Mg2+>Na+>F- | B. | 稳定性:HI<HBr<HCl<HF | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 碱性:Al(OH)3>Mg(OH)2>Ca(OH)2 |
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20mg/kg~40mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.胰岛素 B.甲状腺素
C.生长激素 D.雄性激素
②长期生活在缺碘山区,又得不到食盐的供应,易患C.
A.甲状腺亢进 B.贫血症
C.地方性甲状腺肿大 D.糖尿病
③食盐中加碘,这碘指的是元素(填“元素”、“原子”或“单质”).
④碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CHOH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2$\stackrel{Br}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{醇溶液}^{NaOH}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br}{→}$CH2BrCH2Br | |
| D. | CH2BrCH2Br$\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{Br}{→}$CH2BrCH2Br |
 、
、