题目内容
14.下列有关化学用语表示正确的是( )| A. | Na2O2的电子式为 Na••∙∙••O∙∙O••∙∙••∙∙••O∙∙O••∙∙Na | |
| B. | NH4Br的电子式: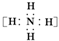 +Br- +Br- | |
| C. | 氢氧根离子的电子式:[••∙∙••••O∙∙∙∙O••∙∙H]- | |
| D. | HClO的电子式:H••∙∙••••CI∙∙∙∙CI••∙∙••••O∙∙∙∙O••∙∙ |
分析 A、Na2O2是钠离子和过氧根离子构成的离子化合物;
B、溴离子最外层达到8电子稳定结构,没有标出其最外层电子;
C、氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子;
D、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键.
解答 解:A、Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,故A错误;
,故A错误;
B、溴化铵为离子化合物,其电子式需要标出所有原子的最外层电子,溴化铵正确的电子式为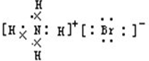 ,故B错误;
,故B错误;
C、氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为 ,故C正确;
,故C正确;
D、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为 ,故D错误;
,故D错误;
故选C.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
4.下列变化过程中,需吸收能量的是( )
| A. | H+H→H2 | B. | H+Cl→HCl | C. | I2→I+I | D. | C+O2→CO2 |
5.苯与乙烯、乙炔相比较,下列叙述不正确的是( )
| A. | 同质量的乙炔和苯完全燃烧生成二氧化碳的质量完全相等 | |
| B. | 都容易发生取代反应 | |
| C. | 苯只能在特殊条件下发生加成反应 | |
| D. | 苯不能被KmnO4所氧化 |
9.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | 钠极易和水反应而被还原 | |
| D. | 钠、氧化钠、氢氧化钠的焰色反应均显黄色 |
19.下表是某地区市场上销售的一种“加碘食盐”的包装袋上的部分文字说明.请根据下表回答下列问题.
①碘是合成下列哪种激素的主要原料之一B.
A.胰岛素 B.甲状腺素
C.生长激素 D.雄性激素
②长期生活在缺碘山区,又得不到食盐的供应,易患C.
A.甲状腺亢进 B.贫血症
C.地方性甲状腺肿大 D.糖尿病
③食盐中加碘,这碘指的是元素(填“元素”、“原子”或“单质”).
④碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20mg/kg~40mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.胰岛素 B.甲状腺素
C.生长激素 D.雄性激素
②长期生活在缺碘山区,又得不到食盐的供应,易患C.
A.甲状腺亢进 B.贫血症
C.地方性甲状腺肿大 D.糖尿病
③食盐中加碘,这碘指的是元素(填“元素”、“原子”或“单质”).
④碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
6.决定粒子是否为同一种元素的是( )
| A. | 粒子内所具有的质子数 | B. | 原子核内的质子数 | ||
| C. | 原子或单核离子的质量数 | D. | 原子核外的电子数 |
4.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 铍原子失电子的能力比钙弱 | B. | 砹的氢化物不如碘化氢稳定 | ||
| C. | 硒酸的酸性比硫酸强 | D. | 氢氧化锶的碱性比氢氧化钙强 |
 、
、
 ②酚醛树脂
②酚醛树脂 ③TNT
③TNT
 E、
E、 与
与