题目内容
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2 ? 2H2O)。
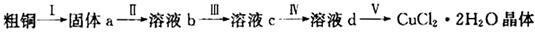
(1)为了完成步骤I,可采用如下图所示的装置将粗铜转化为固体a。
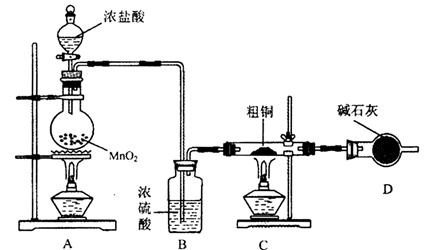
在该实验中,加热A、C装置中的酒精灯时,应该先点燃_______装置的酒精灯,D装置的作用是
_______,C装置中生成的产物是_______。
(2)步骤II中的操作是:将步骤I中的固体加入到容器中,然后加入_______,固体完全溶解。
(3)步骤III中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式______________。
(4) 步骤IV中应先加入某试剂,然后过滤得到滤液。为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是_______。
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O晶体。现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2 ? 2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是_____。
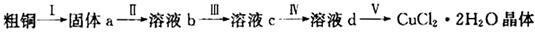
(1)为了完成步骤I,可采用如下图所示的装置将粗铜转化为固体a。

在该实验中,加热A、C装置中的酒精灯时,应该先点燃_______装置的酒精灯,D装置的作用是
_______,C装置中生成的产物是_______。
(2)步骤II中的操作是:将步骤I中的固体加入到容器中,然后加入_______,固体完全溶解。
(3)步骤III中加入的试剂是H2O2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式______________。
(4) 步骤IV中应先加入某试剂,然后过滤得到滤液。为了调节溶液的pH只使Fe3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是_______。
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl2·2H2O晶体。现欲得到无水CuCl2,在实验室也可以采用上述装置完成CuCl2 ? 2H2O脱水得到无水CuCl2,则A装置中的两种化学试剂是_____。
(每空2分,共计14分)(1)A;吸收尾气;CuCl2、FeCl3 (2)稀盐酸
(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4)加入的氨气或NaOH溶液引入杂质,且试剂的量不容易控制
(5)浓硫酸、氯化钠晶体(或浓盐酸)
(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4)加入的氨气或NaOH溶液引入杂质,且试剂的量不容易控制
(5)浓硫酸、氯化钠晶体(或浓盐酸)
试题分析:(1)由于装置中含有空气,在加热的条件下,空气能氧化单质铜。所以要首先加热A处的酒精灯,利用生成的氯气将空气排尽;由于氯气有毒,所以小于尾气处理,因此D装置中碱石灰的作用是吸收尾气;粗铜中含有铁,因此在加热的条件下,两种金属均能和氯气发生化合反应,所以C装置中生成的产物是CuCl2、FeCl3。
(2)由于氯化铜和氯化铁在溶液中均发生水解反应,所以溶解固体使应该用稀盐酸溶解。
(3)双氧水具有氧化性,可以把溶液中的亚铁离子氧化生成铁离子而除去,反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O。
(4)根据流程可知,加入试剂的目的是用于调节pH以除去杂质铁离子。NaOH引入杂质钠离子,NH3?H2O会入杂质铵根离子,且二者的用量不容易控制,因此一般用氧化铜而不用氨水或氢氧化钠溶液。
(5)由于氯化铜水解生成氢氧化铜和氯化氢,所以在加热时应该在氯化氢中的气氛中完成,所以A装置的作用就是制备氯化氢,因此需要的两种化学试剂是浓硫酸和氯化钠晶体。

练习册系列答案
相关题目
 NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。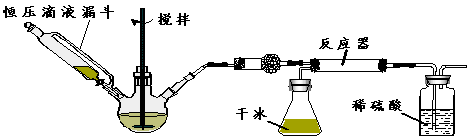
 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。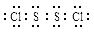 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: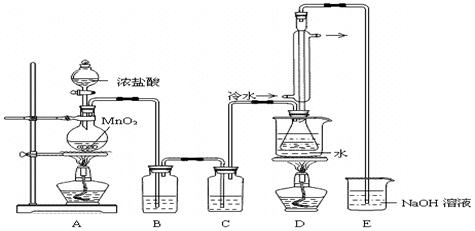
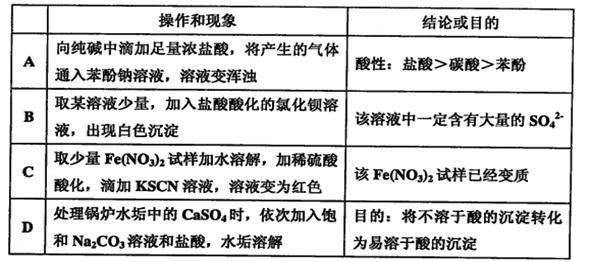
 Fe2+ + Ag+。下列铁盐中洗涤效果最好的是
Fe2+ + Ag+。下列铁盐中洗涤效果最好的是

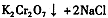 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。