题目内容
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
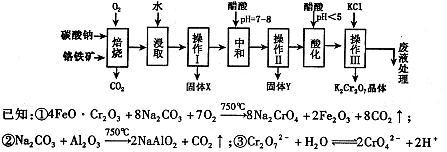
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
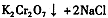 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。

(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。

根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是

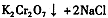 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
(15分)
⑴Fe2O3、MgO(2分);pH计或精密pH试纸(1分)。
⑵使CrO42-转化为Cr2O72-(3分)
⑶冷却结晶,洗涤(各1分)
⑷K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)。(2分)
⑸NaOH溶液、通入过量二氧化碳。(各1分)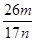 (3分)
(3分)
⑴Fe2O3、MgO(2分);pH计或精密pH试纸(1分)。
⑵使CrO42-转化为Cr2O72-(3分)
⑶冷却结晶,洗涤(各1分)
⑷K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)。(2分)
⑸NaOH溶液、通入过量二氧化碳。(各1分)
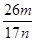 (3分)
(3分)试题分析:⑴加热焙烧时FeO·Cr2O3、Al2O3、转化成了可溶性的Na2CrO4、NaAlO2,用水浸取后过滤,滤渣为MgO、Fe2O3;测pH是否等于4.5,应用pH计或精密pH试纸
⑵酸化步骤用醋酸调节溶液pH <5,其目的是使CrO42-转化为Cr2O72-。
⑶按操作的过程可看出差的两步是:冷却结晶,洗涤。
⑷K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小)。
⑸依题意应先把氢氧化铝转化为可溶性的偏铝酸钠,过滤除杂质,再将偏铝酸钠转化为氢氧化铝,最后变为氧化铝m g。故先加过量NaOH溶液、再通入过量二氧化碳。氢氧化铝质量分数为(
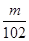 ×78×2) ÷n=
×78×2) ÷n=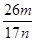

练习册系列答案
相关题目
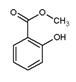 )具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸(
)具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸( )与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )
)与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )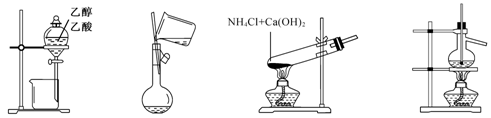
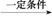 CH3CH2CH2CHO
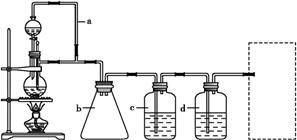
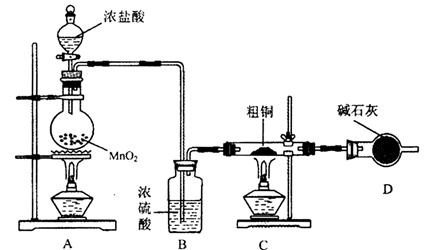
CH3CH2CH2CHO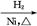 CH3CH2CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2CH2OH;CO的制备原理:HCOOH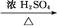 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。