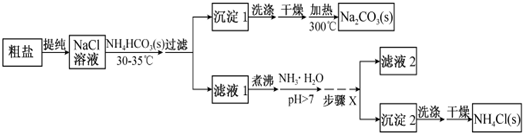
题目内容
17.亚氯酸钠(NaClO2)与足量浓盐酸反应制备环保型消毒剂二氧化氯(ClO2),在该反应中,还原剂与还原产物的物质的质量之比为( )| A. | 4:5 | B. | 1:1 | C. | 1:5 | D. | 4:1 |
分析 根据题意,NaClO2氧化浓盐酸生成氯化钠、氯气、二氧化氯、水,根据氧化还原反应中,化合价升高数值=化合价降低值=转移电子数,据电子守恒来配平方程式,根据化学方程式判断化合价升高的为还原剂,化合价降低的为氧化剂生成对应的产物为还原产物,据此分析.
解答 解:根据题意,NaClO2氧化浓盐酸生成氯化钠、二氧化氯、水,NaClO2中Cl化合价由+3升高到+4,NaClO2中Cl化合价由+3降低到-1价,据电子守恒来配平方程式为5NaClO2+4HCl(浓)=5NaCl+4ClO2↑+2H2O,根据化合价升高的为还原剂,化合价降低的为氧化剂生成对应的产物为还原产物,所以还原剂与还原产物的物质的质量之比为4:1
故选:D.
点评 本题考查了氧化还原反应的书写及其基本概念的判断,明确元素化合价变化是解本题关键,难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
7.室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙两烧杯中溶液的描述不正确的是( )
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)=═c(OH-)乙 | |
| C. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,消耗NaOH溶液的体积不相同 |
16.下列设计的实验方案能达到实验目的是( )
| A. | 制备O2:用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| B. | 提纯含有少量HCl的Cl2:将含有少量HCl的Cl2通入饱和的NaHCO3溶液和浓硫酸中净化气体 | |
| C. | 检验溶液中是否含有CO32-:向溶液中加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量的CO32- | |
| D. | 探究测定铝箔中氧化铝含量:取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(标准状况) |
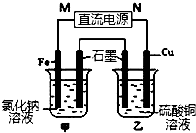 如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).
如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).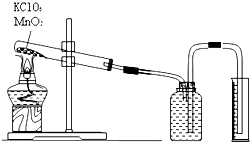 某小组设计利用氯酸钾制氧气来测定气体摩尔体积的探究实验.装置
某小组设计利用氯酸钾制氧气来测定气体摩尔体积的探究实验.装置