题目内容
在10℃和4atm的条件下,在一个体积可变的密闭容器中进行如下反应:aA(g)?dD(g)+eE(g),当反应平衡建立后,维持温度不变,改变压强测定D的浓度变化如下:
(1)压强从4atm增加到6atm时,平衡向 方向移动(填“正反应”、“逆反应”),理由是 .
(2)压强从10atm增加到20atm时,平衡向 方向移动(填“正反应”、“逆反应”),此时平衡向该方向移动的两个必要的条件是:(1) ;(2) .
(3)在10℃和20atm条件下,该反应的平衡常数表达式为 .
| 压强(atm) | 4 | 6 | 10 | 20 |
| D的浓度(mol?L-1) | 0.085 | 0.126 | 0.200 | 0.440 |
(2)压强从10atm增加到20atm时,平衡向
(3)在10℃和20atm条件下,该反应的平衡常数表达式为
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)压强从4atm增加到6atm时,D的浓度应变化为0.085mol/L的1.5倍即为0.1275mol/L,而图表中变化为0.126mol/L,说明平衡逆向进行;
(2)压强从10atm增加到20atm时,D的浓度应变化为0.2mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行;根据①可知反应是气体体积增大的反应,所以此时E加压变为液体或固体,a>d时,才能在加压条件下向正向进行;
(3)平衡常数表达式=
,注意不列入非气态物质.
(2)压强从10atm增加到20atm时,D的浓度应变化为0.2mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行;根据①可知反应是气体体积增大的反应,所以此时E加压变为液体或固体,a>d时,才能在加压条件下向正向进行;
(3)平衡常数表达式=
| 生成物浓度的幂次方 |
| 反应物浓度幂次方 |
解答:
解:(1)压强从4×105Pa增加到6×105 Pa时,D的浓度应变化为0.085mol/L的1.5倍即为0.1275mol/L,而图表中变化为0.126mol/L,说明平衡逆向进行,
故答案为:逆反应;加压时生成物D浓度增大的倍数小于压强增大的倍数;
(2)压强从1×106 Pa 增加到2×106 Pa时,D的浓度应变化为0.2mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行;根据①可知反应是气体体积增大的反应,所以此时E加压变为液体或固体,a>d时,才能在加压条件下向正向进行,
故答案为:正反应;a>d;生成物E在该条件下的状态为非气态;
(3)平衡常数表达式=
,注意不列入非气态物质,所以其平衡常数表达式为K=
,故答案为:K=
.
故答案为:逆反应;加压时生成物D浓度增大的倍数小于压强增大的倍数;
(2)压强从1×106 Pa 增加到2×106 Pa时,D的浓度应变化为0.2mol/L的2倍即0.4mol/L,而图表中D的浓度为0.44mol/L,说明平衡正向进行;根据①可知反应是气体体积增大的反应,所以此时E加压变为液体或固体,a>d时,才能在加压条件下向正向进行,
故答案为:正反应;a>d;生成物E在该条件下的状态为非气态;
(3)平衡常数表达式=
| 生成物浓度的幂次方 |
| 反应物浓度幂次方 |
| [D]d |
| [A]a |
| [D]d |
| [A]a |
点评:本题考查了化学平衡的条件改变、化学平衡常数表达式的书写、平衡移动方向的判断方法应用,理解条件改变对平衡的影响,注意改变压强对物质浓度的影响判断和平衡对物质浓度的影响判断.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
合金在生产及科研中具有广泛的应用.下列物质不属于合金的是( )
| A、铝箔 | B、青铜 | C、铁板 | D、不锈钢 |
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、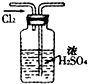 干燥氯气 |
B、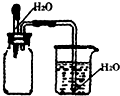 检验气体是否易溶于水 |
C、 制取并收集氨气 |
D、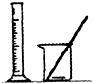 配制50mL 0.10mol?L-1 KI溶液 |
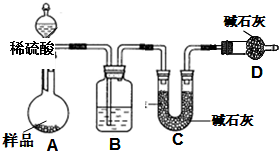
 (1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO