题目内容
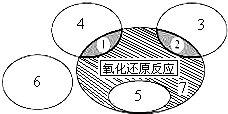 (1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
| ||
A.2H2+O2
| ||
B.2NaHCO3
| ||
C.Zn+H2SO4=ZnSO4+H2↑
D.CuO+CO
| ||
(2)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知:该反应中H2O2只发生如下过程:H2O2→O2.
①该反应中,发生还原反应的物质是
②写出该反应的化学方程式(不用配平)
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)“H2+CuO
Cu+H2O”反应为置换反应,一定属于氧化还原反应;区域7为氧化还原反应,但不属于置换反应;
(2)H2O2只发生如下过程:H2O2→O2,O元素的化合价升高,则Cr元素的化合价降低,还原过程为H2CrO4→Cr(OH)3,则发生H2CrO4+H2O2→Cr(OH)3+H2O+O2↑,结合电子守恒及质量守恒定律解答.
| ||
(2)H2O2只发生如下过程:H2O2→O2,O元素的化合价升高,则Cr元素的化合价降低,还原过程为H2CrO4→Cr(OH)3,则发生H2CrO4+H2O2→Cr(OH)3+H2O+O2↑,结合电子守恒及质量守恒定律解答.
解答:
解:(1)“H2+CuO
Cu+H2O”反应为置换反应,一定属于氧化还原反应,则应为图中区域5;
区域7为氧化还原反应,但不属于置换反应,则
A.2H2+O2
2H2O为化合反应,也为氧化还原反应,为区域1或2,故A不选;
B.2NaHCO3
Na2CO3+H2O+CO2↑为分解反应,也为非氧化还原反应,为区域3或4,故B不选;
C.Zn+H2SO4=ZnSO4+H2↑为置换反应,也为氧化还原反应,为区域5,故C不选;
D.CuO+CO
Cu+CO2为氧化还原反应,但不属于置换反应,则为区域7,故D选;
故答案为:5;D;
(2)①由O元素的化合价升高可知,H2O2为还原剂,被氧化,发生氧化反应,而Cr元素的化合价降低,还原过程为H2CrO4→Cr(OH)3,则H2CrO4发生还原反应,
故答案为:H2CrO4;
②发生H2CrO4+H2O2→Cr(OH)3+H2O+O2↑,Cr元素的化合价由+6价降低为+3价,O元素的化合价由-1价升高为0,由电子守恒可知2H2CrO4+3H2O2→2Cr(OH)3+H2O+3O2↑,再由H原子守恒可知,3H2O2+2H2CrO4=2Cr(OH)3+3O2↑+2H2O,
故答案为:H2O2;H2CrO4;Cr(OH)3;O2↑;H2O.
| ||
区域7为氧化还原反应,但不属于置换反应,则
A.2H2+O2
| ||
B.2NaHCO3
| ||
C.Zn+H2SO4=ZnSO4+H2↑为置换反应,也为氧化还原反应,为区域5,故C不选;
D.CuO+CO
| ||
故答案为:5;D;
(2)①由O元素的化合价升高可知,H2O2为还原剂,被氧化,发生氧化反应,而Cr元素的化合价降低,还原过程为H2CrO4→Cr(OH)3,则H2CrO4发生还原反应,
故答案为:H2CrO4;
②发生H2CrO4+H2O2→Cr(OH)3+H2O+O2↑,Cr元素的化合价由+6价降低为+3价,O元素的化合价由-1价升高为0,由电子守恒可知2H2CrO4+3H2O2→2Cr(OH)3+H2O+3O2↑,再由H原子守恒可知,3H2O2+2H2CrO4=2Cr(OH)3+3O2↑+2H2O,
故答案为:H2O2;H2CrO4;Cr(OH)3;O2↑;H2O.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析能力的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①澄清石灰水中通过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸.
①澄清石灰水中通过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸.
| A、②④ | B、③④ | C、④ | D、①③ |
下列离子方程式正确的是( )
| A、NaHS溶液中HS-水解:HS-+H2O?S2-+H3O+ |
| B、氯化铵水解:NH4++H2O?NH3?H2O+H+ |
| C、向NaHCO3 溶液中加入过量的Ca(OH)2溶液:2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32- |
| D、碳酸钠溶液显碱性的原因:CO32-+2H2O?H2 CO3+2OH- |
 已知A、B、C、D四种短周期元素.在元素周期表中的相对位置如下图所示,其中B元素的氧化物是形成酸雨的主要成分.请填空:
已知A、B、C、D四种短周期元素.在元素周期表中的相对位置如下图所示,其中B元素的氧化物是形成酸雨的主要成分.请填空: 维生素A对人体特别是对人的视力有重要作用,其结构简式如图:
维生素A对人体特别是对人的视力有重要作用,其结构简式如图: