题目内容
17.下列离子方程式不正确的是( )| A. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
分析 A.稀硫酸与碱式碳酸铜反应生成硫酸铜、二氧化碳气体和水;
B.稀硝酸具有强氧化性,能够将亚铁离子氧化成铁离子;
C.硫酸根离子恰好生成时,硫酸铝铵与氢氧化钡的物质的量之比为1:2,由于铵根离子结合氢氧根离子能力大于氢氧化铝,则反应生成氢氧化铝沉淀和一水合氨;
D.氢氧化钙少量,离子方程式按照氢氧化钙的化学式组成书写,反应离子方程式中碳酸根离子有剩余.
解答 解:A.用稀硫酸除去铜绿,反应的离子方程式为:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O,故A正确;
B.Fe3O4与稀硝酸反应生成硝酸铁、一氧化氮气体和水,正确的离子方程式为:3Fe3O4+28H++NO3-=NO↑+9Fe3++14H2O,故B错误;
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,硫酸铝铵与氢氧化钡的物质的量之比为1:2,由于铵根离子结合氢氧根离子能力大于氢氧化铝,则反应生成氢氧化铝沉淀和一水合氨,反应的离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故C正确;
D.少量氢氧化钙溶液与碳酸氢钠溶液混合,反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确 判断离子方程式正误的常用方法,B、C为易错点,B注意稀硝酸能够氧化亚铁离子、C明确铵根离子结合氢氧根离子能力大于氢氧化铝.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
7.下列叙述正确的是( )
| A. | 将二氧化硫气体通入浅黄色的溴水中使其颜色褪去,说明二氧化硫具有漂白性 | |
| B. | Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 | |
| C. | 用砂纸打磨过的铝箔放在酒精灯焰上不燃烧,说明铝不易与O2反应 | |
| D. | 向装有NaHCO3溶液的两支试管中各滴入CaCl2和MgCl2的饱和溶液,后者有沉淀呈现 |
8.一定条件下将0.5mol SO2和一定量O2通入恒容密闭容器中,压强为4.04×105Pa,在恒温(500℃)下反应达到平衡,压强为3.03×105Pa,测得余0.1mol O2,则SO2的转化率为( )
| A. | 80% | B. | 75% | C. | 60% | D. | 40% |
5.实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是( )
| A. | F2→F- | B. | HNO3→NO | C. | Mg→Mg2+ | D. | Na2O2→O2 |
12.运用有关概念判断下列叙述正确的是( )
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
2.下列分子的中心原子采取sp杂化的是( )
| A. | XeO4 | B. | BeCl2 | C. | CH4 | D. | PCl3 |
20. 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )| A. | P3>P4,Y轴表示混合气体的平均摩尔质量 | |
| B. | P3>P4,Y轴表示混合气体的密度 | |
| C. | P3<P4,Y轴表示A2的浓度 | |
| D. | P3<P4,Y轴表示A2的转化率 |
1.下列物质中:互为同分异构体的是( )
| A. | 液氯、氯气 | B. | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C. | N2、CO | D. | 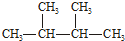 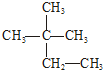 |