题目内容
7.下列叙述正确的是( )| A. | 将二氧化硫气体通入浅黄色的溴水中使其颜色褪去,说明二氧化硫具有漂白性 | |
| B. | Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 | |
| C. | 用砂纸打磨过的铝箔放在酒精灯焰上不燃烧,说明铝不易与O2反应 | |
| D. | 向装有NaHCO3溶液的两支试管中各滴入CaCl2和MgCl2的饱和溶液,后者有沉淀呈现 |
分析 A.二氧化硫具有还原性,能被强氧化剂氧化;
B.铁和水蒸气在高温下反应生成四氧化三铁和氢气;
C.氧化铝的熔点高于铝单质;
D.碳酸氢钙易溶于水,氢氧化镁难溶液水.
解答 解:A.二氧化硫具有还原性,能被强氧化剂氧化,溴具有强氧化性,所以二氧化硫和溴水发生氧化还原反应生成硫酸、HBr,导致溶液溴水褪色,该反应体现二氧化硫的还原性而不是漂白性,故A错误;
B.钠和冷水反应生成NaOH和氢气,加热条件下,镁和水反应生成氢氧化镁和氢气,但铁和水蒸气在高温下反应生成四氧化三铁和氢气,故B错误;
C.铝属于亲氧元素,极易被氧气氧化生成氧化铝,氧化铝的熔点高于铝单质,所以熔融氧化铝兜着铝而导致铝不能燃烧,故C错误;
D.碳酸氢钙易溶于水,氢氧化镁难溶液水,碳酸氢钠和氯化钙混合不符合复分解反应条件,所以没有沉淀生成,碳酸氢钠和氯化镁发生双水解反应生成氢氧化镁沉淀,所以现象不同,故D正确;
故选D.
点评 本题考查元素化合物性质,为高频考点,明确物质的性质是解本题关键,易错选项是AB,注意二氧化硫漂白性和还原性区别,注意铁和水蒸气反应生成物成分,题目难度不大.

练习册系列答案
相关题目
17.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
18.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3二丁烯 | B. | 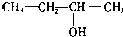 3-丁醇 | ||
| C. | 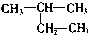 2-甲基丁烷 2-甲基丁烷 | D. |  甲基苯酚 甲基苯酚 |
15.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好使电解液恢复到电解前的浓度和pH(不考虑CO2的溶解).则电解过程中共转移电子的物质的量为( )
| A. | 0.1mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
2.下列化学反应,能用离子方程式H++OH-=H2O表示的是( )
| A. | NaOH溶液和CO2反应 | B. | Cu(OH)2溶液和稀H2SO4反应 | ||
| C. | 氢氧化钡溶液和硝酸反应 | D. | 氨水和稀H2SO4反应 |
16.下列说法正确的是( )
| A. | 0.03mol/L HA与0.03mol/L NaA等体积混合得到的碱性溶液中:c(Na+)>c(A--) | |
| B. | 酸性溶液中水的电离程度一定比纯水的电离程度小 | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液c(NaOH)<c(CH3COONa<c((Na2CO3 | |
| D. | 室温下,pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后,pH大于7 |
17.下列离子方程式不正确的是( )
| A. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |