题目内容
5.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| B. | IA族与ⅦA族元素间可形成离子键也可形成共价键 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
分析 A.在以酸性强弱作为判断元素非金属性强弱时,是以最高价氧化物对应水化物的酸性强弱为判断依据的;
B.ⅠA族为H和碱金属,ⅦA族元素为非金属元素;
C.电子排布相同的离子,原子序数越大,半径越小;
D.同周期金属元素的化合价越高,失电子能力越弱.
解答 解:A.元素非金属性强越强,对应的最高价氧化物对应水化物的酸性越强,与氢化物的酸性无关,故A错误;
B.ⅠA族为H和碱金属,ⅦA族元素为非金属元素,H与卤族元素形成共价化合物,碱金属元素与卤族元素形成离子化合物,故B正确;
C.电子排布相同的离子,原子序数越大,半径越小,则S2-、Cl-、K+、Ca2+半径逐渐减小,故C错误;
D.同周期金属元素的化合价越高,失电子能力越弱,如Na、Mg、Al化合价依次升高,原子失电子能力依次减弱,故D错误.
故选B.
点评 本题考查元素周期表和元素周期律的应用,注意同周期、同主族元素的性质变化规律是解答本题的关键,注意利用实例分析问题,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
15.提纯下列物质(括号内为杂质),选用的除杂试剂与分离方法正确的是( )
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 苯(Br2) | KOH溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
16.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
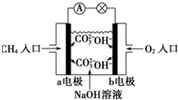

| A. | a极是负极,发生氧化反应 | |
| B. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| C. | 该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O | |
| D. | 甲烷燃料电池是环保电池 |
13.氨分子空间构型是三角锥形,键角小于109°28′,而甲烷是正四面体,键角等于109°28′,键角差别是因为( )
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强 | |
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
17.下列变化中,不破坏化学键的是( )
| A. | HCl溶于水 | B. | 碘的升华 | C. | 水的电解 | D. | 金刚石熔化 |
14.已知酸性: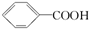 >H2CO3>
>H2CO3>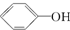 ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 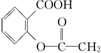 转变为
转变为 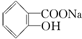 的最佳方法是( )
的最佳方法是( )
 >H2CO3>
>H2CO3> ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为  的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与足量的NaOH溶液共热后,再加入适量H2SO4 |
7.下列各物质的化学式、对应的名称(或俗名)、物质所属的类别都正确的是( )
| A. | Na2O2 过氧化钠 碱性氧化物 | B. | CO2二氧化碳 酸性氧化物 | ||
| C. | H2SO3硫酸 酸 | D. | Na2CO3 纯碱 碱 |
 ;
;